
【题目】在一定温度下,石灰乳达到平衡:Ca(OH)2 (s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A.加水,Ca(OH)2 溶解平衡向右移动,pH 增大
B.加入少量盐酸,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
C.加入少量氢氧化钠固体,Ca(OH)2 溶解平衡向左移动,溶液中 c(H+)减小
D.升高温度,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
科目:高中化学 来源: 题型:
【题目】能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池:

Cu电极是___(填“正”或“负”)极,其电极反应式为___;电子由___极流出。
(2)利用(1)图中的电极和电解液,在增加电源后可以实现电能转化为化学能,Fe接入电源负极,Cu接入电源正极,电解过程电极质量增加的是___(填“Fe”或“Cu”),Fe的腐蚀速度比正常在空气中的腐蚀速度___(填“快”或“慢”),溶液中c(Cu2+)___(填“增大”、“减小”或“不变”)。
(3)利用氢气与氧气的燃烧反应2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,作为燃料电池的反应原理,可以提高能量的利用率,填充H2的电极是____(填“正”或“负”)极;当有11.2L(折算成标准状况下的体积)H2反应,会放出___kJ热量;如果2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,则a___571.6(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmolˉ1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H++OH-=H2O; △H =-57.3 kJmolˉ1
C.已知 H2 燃烧热为 142.9kJmolˉ1 ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H =-285.8 kJmolˉ1
D.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ;△H=-38.6kJ· mol-1
2NH3(g) ;△H=-38.6kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示,下列有关柠檬烯的说法正确的是( )
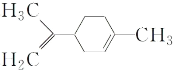
A.它的一氯代物有 7 种
B.它与足量氢气反应后生成的分子中所有的碳原子可能在同一平面上
C.它与足量的溴水反应后,产物的化学式为:C10H14Br4
D.一定条件下,它可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,其中可能含有KCl、Ba(NO3)2、CuSO4、Na2CO3,现通过以下实验流程进行检验(假设物质间的反应恰好完全)。回答下列问题:
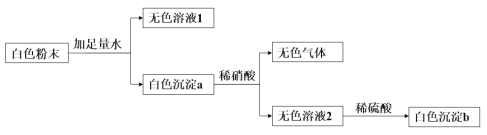
(1)白色粉末中一定没有的物质是_____________(填化学式,下同)。
(2)无色溶液1中一定含有的溶质___________,是可能含有的溶质是___________。
(3)生成无色气体的化学方程式为__________________________________;该反应属于____________(填反应基本类型).
(4)生成白色沉淀b的离子方程式为__________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素![]() 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图![]() 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极![]() 。
。

(1)图1中N型半导体为______![]() 填“正极”或“负极”
填“正极”或“负极”![]()
(2)该系统工作时,A极的电极反应式为______
(3)若A极产生![]()
![]() ,则此时B极产生______L
,则此时B极产生______L![]() 标况下
标况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)硫化钠水解的离子方程式:________________________________。
(3)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(4)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(5)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(6)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(7)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:
HSO3-+H2O![]() H2SO3+OH- ①
H2SO3+OH- ①
HSO3-![]() H++SO32- ②
H++SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
C.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)
D.加入少量NaOH溶液,![]() 、
、![]() 的值均增大
的值均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com