
【题目】一定温度下,反应N2O4(g) ![]() 2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
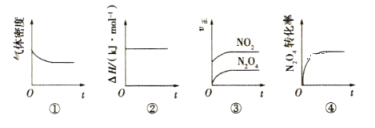
A. ①②B. ②④C. ③④D. ①④
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
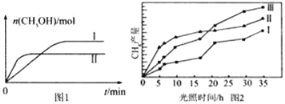
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
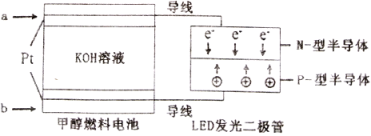
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5).其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为:_____________________________________________________ .
(2)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:__________________________.
(3)反应I时应先通的气体为______,副产品X的化学式是______.
(4)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为______.检验产品中含有碳酸钠杂质所需试剂是______(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水
④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.钠具有强还原性,可用于制作高压钠灯
B.活性炭具有吸附性,可用于吸附水中的杂质
C.Al2O3是两性氧化物,可用作耐高温材料
D.明矾易溶于水,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
干海带![]() 海带灰
海带灰![]() 水溶液
水溶液![]()
![]()
![]() ―→碘单质
―→碘单质
下列有关叙述正确的是( )
A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__________min(填0~1、1~2、2~3、3~4、4~5),原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(_________)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
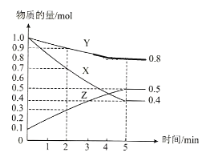
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A X、Y、Z的反应速率相等
B X、Y的反应速率比为3:1
C 容器内气体压强保持不变
D 生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )
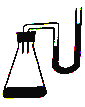
① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅的叙述中,正确的是( )
A. 二氧化硅可用于光导纤维,利用了它的导电性
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态形式存在
D. 硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com