
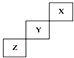
| A. | X单质的熔点比Z的低 | |
| B. | X、Y、Z三种元素中,X的非金属性最强 | |
| C. | Y氢化物的稳定性比Z的氢化物弱 | |
| D. | Y的最高正化合价为+7 |
分析 这几种元素为短周期元素,根据元素在周期表中的位置知,X、Y、Z分别是He、F、S元素,
A.X、Z单质分别是氦气、S,二者都是分子晶体,分子晶体熔沸点与其相对分子质量成正比;
B.稀有气体最外层达到稳定结构,不易得电子也不易失电子;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.F元素是非金属性最强的元素,没有正化合价.
解答 解:这几种元素为短周期元素,根据元素在周期表中的位置知,X、Y、Z分别是He、F、S元素,
A.X、Z单质分别是氦气、S,二者都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,所以S单质的熔点大于氦气,故A正确;
B.稀有气体最外层达到稳定结构,不易得电子也不易失电子,所以X的非金属性最弱,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Y>Z,所以Y氢化物的稳定性比Z的氢化物强,故C错误;
D.F元素是非金属性最强的元素,没有正化合价,即Y元素没有正化合价,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,涉及晶体熔沸点高低判断、元素非金属性强弱判断及元素化合物,侧重考查学生分析、比较、判断能力,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | N2的电子式: | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:5 | B. | 3:5:3 | C. | 5:3:3 | D. | 8:7:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| E | F | ||||||
| A | C | D | G | R | |||
| B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
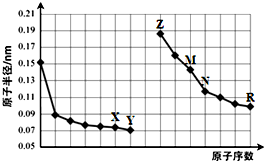
| A. | X、R两种元素的气态氢化物的稳定性:R>X | |
| B. | 简单离子的半径:Y>Z>M | |
| C. | N的单质能与Z的最高价氧化物对应的水化物反应 | |
| D. | Z与X两种元素形成的化合物都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{N}$(N-a)mol | B. | $\frac{a}{A+16}$(A-N+10)mol | C. | $\frac{a}{A+8}$(N+n)mol | D. | $\frac{a}{A+16}$(A-N+8)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com