
【题目】化学中的某些元素是与生命活动密不可分的元素,请回答下列问题.
(1)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图1所示.①维生素C分子中碳原子的杂化方式有 .
②1mol维生素C分子中含有mol π键.
③维生素C分子中所含元素电负性由大到小的顺序为 .
④维生素C晶体溶于水的过程中要克服的微粒间作用力有 .
(2)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物.Fe3+的价电子排布为 , 与之形成配合物的分子或离子中的配位原子应具备的结构特征是 .
(3)Fe3O4具有反尖晶石结构.某化合物MgxAlyOz与反尖晶石结构相仿,其结构如2图所示,它是由下列A、B方块组成.该化合物的化学式为 . 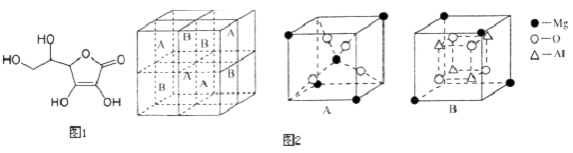
【答案】
(1)sp3和sp2;2;O>C>H;氢键、范德华力
(2)3d5;有孤电子对
(3)MgAl2O4
【解析】解:(1)①维生素C分子中碳原子以单键形式存在的,其价层电子对个数是4,含有双键的C原子的价层电子对个数是3,所以C原子杂化方式为sp3杂化、sp2杂化,所以答案是:sp3和sp2;②双键中含有1个π键,则1mol分子中含有2mol双键,即含有2mol π键,所以答案是:2mol;③.非金属性越强,电负性越强,非金属性:O>C>H,则电负性:O>C>H,所以答案是:O>C>H;④维生素C分子间存在范德华力,分子中含有羟基,羟基间能形成氢键,所以维生素C晶体溶于水的过程中要克服的微粒间作用力有氢键、范德华力,所以答案是:氢键、范德华力;(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2 , Fe失去三个电子得到Fe3+ , Fe3+的电子排布式为1s22s22p63s23p63d5;所以基态Fe3+的价电子排布式为3d5;形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,则与Fe3+形成配合物的分子或离子中的配位原子应具备的结构特征是有孤电子对;所以答案是:3d5;有孤电子对;(3)该晶胞中Al原子个数为4,O原子个数4+4=8,Mg原子的个数为8× ![]() +1=2,所以化学式为MgAl2O4 , 所以答案是:MgAl2O4 .
+1=2,所以化学式为MgAl2O4 , 所以答案是:MgAl2O4 .


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等
B. 碱性氧化物一定是金属氧化物
C. SO2的水溶液能导电,所以SO2是电解质
D. 金刚石不导电,因此金刚石是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.1 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.35 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2 (红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 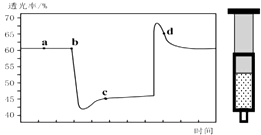
A.b点的操作是压缩注射器,平衡正向移动
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
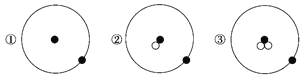
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是( )
a.①②③互为同位素 b.①②③互为同素异形体 c.①②③是三种化学性质不同的粒子 d.①②③具有相同的质量数 e.①②③具有相同的质量 f.①②③是三种不同的原子
A. a、f B. b、c C. d、e D. e、f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO22Mn2++5S +2H2O
B. 氯化铝溶液中加入过量氨水:Al3++4OH-AlO2+2H2O
C. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3- +2OH-![]() NH3↑+SO32+2H2O
NH3↑+SO32+2H2O
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下五种不同基团两两结合而形成的化合物,能与NaOH溶液反应的共有( )
①﹣CH3②﹣OH③﹣C6H5④﹣CHO⑤﹣COOH.
A.6种
B.5种
C.4种
D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)广泛分布于自然界,其原子结构示意图是 ![]() .
.
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5 , 其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式: . 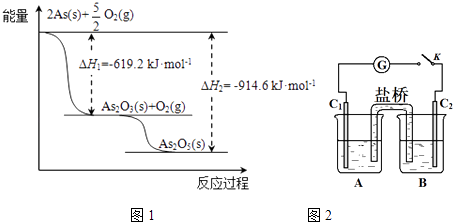
(3)砷酸盐可发生如下反应:AsO43﹣+2I﹣+2HAsO33﹣+I2+H2O.图2装置中,C1、C2是石墨电极
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 .
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”).
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43﹣和AsO33﹣的混合溶液.
As2O5与NaOH溶液反应的离子方程式是 .
②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL.滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。某化学兴趣小组在实验室中对Cl2与FeCl2和KSCN混合溶液的反应进行了探究。回答下列问题:
(1)Cl2为制备
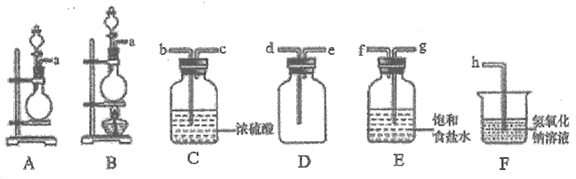
①该小组同学选用KMnO4固体和浓盐酸混合快速制备Cl2,气体发生装置应选择__(填大写字母),该反应的离子方程式为___________。
②欲收集一瓶干燥纯净的氯气,选择上图中的装置,其连接顺序为a→________(按气流方向,用小写字母表示)。
(2)Cl2的性质实验
Cl2与FeCl2和KSCN混合溶液的反应,随着Cl2不断通入,A装置中溶液先变红,后逐渐褪色。
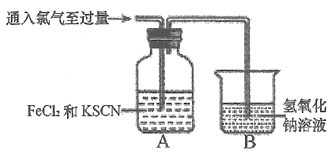
①装置B中发生反应的离子方程式为___________。
②装置A中溶液变红的原因是_________(用离子方程式表示)。
(3)后续实验探究
为了探究上图A装置中溶液红色褪去的原因,该小组取少量A中褪色后的溶液,向其中加入_____(填化学式)后,溶液逐渐恢复为红色,由此得出结论:SCN-被Cl2氧化。
为了探究SCN-被Cl2氧化氧化后的产,该小组又做了如下探究:
①查阅资料,发现SCN-中氮元素为-3价、碳元素为+4价。
②取A中褪色后的溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
③通过实验证明了SCN-中氮元素转化为NO3-。
请结合以上实验探究结果写出SCN-与Cl2反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com