
分析 根据n=$\frac{N}{{N}_{A}}$计算硫酸根离子的物质的量,根据m=nM计算硫酸根离子的质量;根据n=$\frac{m}{M}$计算49gH2SO4的物质的量,硫酸中n(H)=n(H2SO4),根据N=nNA计算H原子数目,原子的物质的量为硫酸分子的7倍.
解答 解:3.01×1023个硫酸根离子约含 $\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol SO42-,其质量为0.5×96=48g,49gH2SO4的物质的量为$\frac{49g}{98g/mol}$=0.5mol,故N(H)=0.5mol×2×6.02×1023mol-1=6.02×1023,含有原子的物质的量为0.5mol×7=3.5mol,所以共含有原子3.5NA,
故答案为:0.5;48;6.02×1023;3.5NA.
点评 本题考查常用化学计量的有关计算、原子数目的计算等,比较基础,注意对公式的理解与灵活运用.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
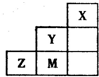
| A. | Y、Z可形成ZY6分子 | B. | X晶体属于原子晶体 | ||
| C. | 原子半径:Z>M>Y | D. | Z离子的结构示意图可表示为: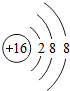 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.015mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 电解质 | 非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| B. | 在常温常压下,1 mol 氦气含有的原子数为2NA | |
| C. | 在常温常压下,71 g Cl2所含原子数为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉溶解于1L0.5mol•L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA | |
| B. | 标准状况下,22.4LSO3的分子数为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,生成了0.2molO2,转移电子的数目为0.8 NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质 | 非电解质 | 强电解质 | 弱电解质 | |
| A | Cu | NH3 | H2SO4 | CH3COOH |
| B | SO3 | 蔗糖 | NaOH | H2CO3 |
| C | NaOH | 酒精 | KCl | BaSO4 |
| D | BaCl2 | SO2 | NaCl | CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com