
830Kʱ�����ܱ������з������п��淴Ӧ��
CO��g��+H2O��g�� CO2��g��+H2��g�� ��H>0
CO2��g��+H2��g�� ��H>0
�Իش��������⣺
��1������ʼʱc��CO��=2 mol��L-1��c��H2O��=3 mol��L-1���ﵽƽ��ʱCO��ת����Ϊ50%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K= .
��2������ͬ�¶��£�����ʼʱc��CO��=1 mol��L-1��c��H2O��=2 mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5 mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬ ����ǡ��롰�������жϵ�������
��3���������¶ȣ��÷�Ӧ��Kֵ�� ���÷�Ӧ�Ļ�ѧ��Ӧ���ʽ� �����������С�����䡱����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӦN2O4(g) 2NO2(g) ��H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ����ȷ����
2NO2(g) ��H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ����ȷ����
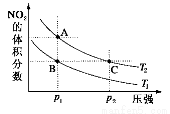
A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C�� A��C���������ƽ����Է���������A��C
D����״̬B��״̬A�������ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��������������һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���е��뷽��ʽ��ȷ����
A��Ba(OH)2 �� Ba2+ + 2OH- B��AlCl3�� Al3+ + Cl3-
C��H2SO4 �� 2H+ + S6+ + 4O2- D��Na2CO3 �� Na2+ + CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��0.05molSO2(g)��0.03molO2(g)�����ݻ�Ϊ1L���ܱ������У���Ӧ2SO2(g)+O2(g)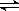 2SO3(g)����һ��������2minʱ�ﵽƽ�⣬���c(SO3)=0.04mol��L-1�����±�����ȷ����
2SO3(g)����һ��������2minʱ�ﵽƽ�⣬���c(SO3)=0.04mol��L-1�����±�����ȷ����
A���������£����뵪������c(SO3)С��0.04mol��L-1
B���������·�Ӧ��ƽ�ⳣ��Ϊ1.6��103
C��v(O2)= 0.02 mol��L-1.min-1
D��ʹ�ô�����ƽ��û���ƶ�����÷�Ӧ�ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
VL Fe2(SO4)3��Һ�к���ag SO42����ȡ����Һ0.5VL����ˮϡ����2VL����ϡ�ͺ���Һ��Fe3�������ʵ�����Ũ��Ϊ
A��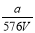 mol/L B��
mol/L B��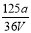 mol/L C��
mol/L C��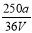 mol/L D��
mol/L D��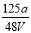 mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�Ͳ��и߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�Է�Ӧ4A+5B 4C+6D�����»�ѧ��Ӧ���ʵı�ʾ�У�����ʾ��Ӧ��������
4C+6D�����»�ѧ��Ӧ���ʵı�ʾ�У�����ʾ��Ӧ��������
A��v (A)=0.40mol•L-1•s-1 B��v (B)=0.48mol•L-1•s-1
C��v (C)=0.36mol•L-1•s-1 D��v (D)=0.55mol•L-1•s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���¶ȡ��ݻ���ͬ��2���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | �� | �� |
��Ӧ��Ͷ���� | 1 mol N2��3 mol H2 | 4 mol NH3 |
NH3��Ũ��(mol��L��1) | c1 | c2 |
��Ӧ�������仯 | �ų�a kJ | ����b kJ |
�����ܶ� | ��1 | ��2 |
��Ӧ��ת���� | ��1 | ��2 |
����֪N2(g)��3H2(g) 2NH3(g)����H����92.4 kJ��mol��1��������˵����ȷ����
2NH3(g)����H����92.4 kJ��mol��1��������˵����ȷ����
A��c1<c2<2c1 B��a��b>92.4 C����1���� 2��1 D����2��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ�����и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A������þ�����ͻ����
B����Na2CO3��Һ�еμӴ�����Һ��һ����CO2��������
C����������ˮ�γɵ�Al(OH)3����������ˮ�������������ˮ�ľ���
D��Na2O2������DZˮͧ�������ߵĹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶���һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں��з�̪��0.1mol��L��1��ˮ�м���������NH4Cl���壬����Һ��ɫ
A������ɫ B������ C.��dz D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com