
| A��800���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.25 |
| B��427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4����÷�Ӧ�ġ�H��0 |
| C��800���£����������ƽ����ϵ��ͨ��1.0mol��CO��g������ƽ��ʱCO���ʵ�������Ϊ33.3% |
| D��800���£����������ƽ����ϵ��ͨ��1.0mol��H2O��g������ƽ��ʱCOת����Ϊ33.3% |
| 0.5��0.5 |
| 0.5��0.5 |
| 0.5 |
| 2 |
| (0.5+x)2 |
| (0.5-x)?(1.5-x) |
| 1 |
| 6 |
| ||
| 3 |
| x2 |
| (2-x)(1-x) |
| 2 |
| 3 |
| ||
| 1 |


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
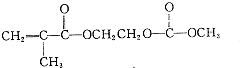
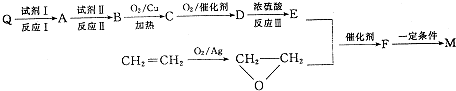
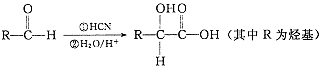
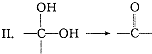
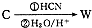 ����д����������������w��һ��ͬ���칹��Ľṹ��ʽ
����д����������������w��һ��ͬ���칹��Ľṹ��ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ��� | B������� |
| C������� | D������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CuO |
| B��Cu��OH��2 |
| C��Cu2O |
| D��Cu2��OH��2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A ��̬ԭ����3���ܼ������ܼ��е�������� |
| B ��̬ԭ�Ӻ�����13�ֲ�ͬ�˶�״̬�ĵ��� |
| C��B����ͬһ���ڣ���ԭ���ڸ������е縺����� |
| D D4+�ĺ�������Ų����ԭ����ͬ |
| E ��ds��ԭ��������С��Ԫ�� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com