


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 是一种重要的香料,主要用于食品、化妆品等工业中.用有机物A为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料,主要用于食品、化妆品等工业中.用有机物A为原料可以合成兔耳草醛,其合成路线如图所示:
| KOH |
| △ |
| -H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.
为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
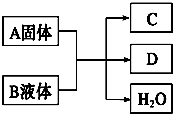 A、B、C、D都是中学常见的物质,在一定的条件下有如下图所示的转化关系(未注明反应条件),请回答下列问题:
A、B、C、D都是中学常见的物质,在一定的条件下有如下图所示的转化关系(未注明反应条件),请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com