
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
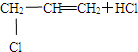 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
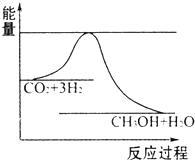 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:| 1 |
| 2O2(g) |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、5NH4NO3
| ||||
| B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
| D、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol-CH3和1 mol OH-都含有10 NA个电子 |
| B、常温常压下,8gCH4含有2NA个共价键 |
| C、1L 0.1 mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下22.4 L 乙醇含碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
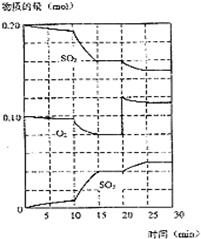 已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:
已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com