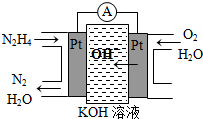
���£�N
2H
4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO
2�Ķ�����N
2O
4���ǻ���г������������Իش���������
��1����ȼ�ϵ��ԭ����ͼ��ʾ����ߵ缫�Ϸ����ĵ缫��ӦʽΪ
N2H4-4e-+4OH-=N2+4H2O
N2H4-4e-+4OH-=N2+4H2O
��
��2���������N
2O
4��������������ȼ�ϣ���֪��
N
2��g��+2O
2��g��=2NO
2��g����H=-67.7kJ?mol
-1N
2H
4��g��+O
2��g��=N
2��g��+2H
2O��g����H=-534.0kJ?mol
-12NO
2��g��?N
2O
4��g����H=-52.7kJ?mol
-1��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��
2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-947.6kJ?mol-1
2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-947.6kJ?mol-1
��
���о�NO
2��SO
2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1��һ�������£���2molNO��2molO
2���ں����ܱ������з�����Ӧ2NO��g��+O
2��g��?2NO
2��g�������и�����˵����Ӧ�ﵽƽ��״̬����
abc
abc
��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��NO��O
2�����ʵ���֮�ȱ��ֲ��� d��ÿ����1molO
2ͬʱ����2molNO
2��2��CO�����ںϳɼ״���һ���¶��£������Ϊ2L���ܱ������м���CO��H
2��������ӦCO��g��+2H
2��g��?CH
3OH��g������ƽ����ø����Ũ�����£�
| ���� |
CO |
H2 |
CH3OH |
| Ũ�ȣ�mol?L-1�� |
0.9 |
1.0 |
0.6 |
����ʽ������ƽ�ⳣ��K=
L
2?moL
-2����0.67L
2?moL
-2��
L
2?moL
-2����0.67L
2?moL
-2��
��
���������¶ȣ�Kֵ������Ӧ�ġ�H
��
��
0���������������
��������������䣬�ٳ���0.6molCO��0.4molCH
3OH����ʱv
��=
=
v
�������������������=������

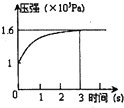 һ���¶��£������Ϊ2L���ܱ������г���1mol PCl5��g����������Ӧ��PCl5��g��?PCl3��g��+Cl2��g����H=+QkJ?mol-1 ά�������¶Ȳ��䣬���������ѹǿ�淴Ӧʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
һ���¶��£������Ϊ2L���ܱ������г���1mol PCl5��g����������Ӧ��PCl5��g��?PCl3��g��+Cl2��g����H=+QkJ?mol-1 ά�������¶Ȳ��䣬���������ѹǿ�淴Ӧʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
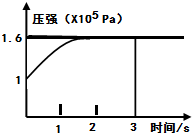 ��2013?����ģ�⣩һ���¶��£������Ϊ2L�ĺ����ܱ������г���1mol PCl5��g����������Ӧ��
��2013?����ģ�⣩һ���¶��£������Ϊ2L�ĺ����ܱ������г���1mol PCl5��g����������Ӧ�� ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش��������� ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺