

分析 (1)电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,反应物为氯化钠、水;
(2)电解熔融氯化镁生成镁和氯气;
(3)原料为海水,应减少交通费用;
(4)除去Ca2+,可加入碳酸钠溶液,生成碳酸钙沉淀,除去Mg2+,可加入氢氧化钠溶液,生成氢氧化镁沉淀;
(5)加碳酸钠要放在加氯化钡之后,可以同时除去过量的钡离子.
解答 解:(1)电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,总反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)电解熔融氯化镁生成镁和氯气,方程式为MgCl2熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(3)原料为海水,应减少交通费用,可设在海岸附近,为避免污染,应远离景区和居民区,故答案为:远离景区、居民区的海岸附近;
(4)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(5)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项bc符合,故答案为:bc.
点评 本题考查了海水资源及其综合应用,题目难度中等,注意掌握化学实验基本操作方法,明确物质分离与提纯方法,特别是除杂试剂的加入顺序,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+). |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中的官能团是酚羟基 | |
| B. | 使用K2Cr2O7酸性溶液检测酒驾,是利用了乙醇的氧化性 | |
| C. | 乙醇可以发生取代、消去和氧化反应 | |
| D. | 将75%的乙醇与98%的浓硫酸混合液迅速加热至170°C以制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: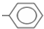 | ||
| C. | 丙烷分子的球棍模型示意图: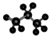 | D. | -CH3(甲基)的电子式为: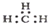 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com