
【题目】如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是
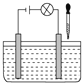
A. 盐酸中逐滴加入食盐溶液
B. NH4Cl溶液中加入适量的NaOH溶液
C. Ba(OH)2溶液中滴入H2SO4溶液至过量
D. 醋酸中逐滴加入氨水
【答案】C
【解析】
A.盐酸溶液中逐滴加入食盐溶液,溶液中一直有电解质电离产生的自由移动的离子,灯泡不会熄灭,A错误;
B.NH4Cl溶液中加入适量的NaOH溶液是一水合氨和氯化钠,溶液中一直有可溶性的电解质电离,自由移动的离子一直存在,因此灯泡不会熄灭,B错误;
C.Ba(OH)2溶液中滴入H2SO4溶液至过量,开始阶段生成硫酸钡沉淀和水,使自由移动的离子浓度逐渐减小,灯光逐渐变暗,当二者恰好反应时,溶液中离子浓度接近0,灯泡熄灭。再滴入H2SO4溶液时,溶液中离子浓度逐渐增大,灯泡逐渐变亮,C正确;
D.醋酸中逐滴加入氨水,生成醋酸铵,弱电解质变为强电解质,自由移动的离子浓度逐渐增大,溶液导电性逐渐增强,灯泡不可能熄灭,D错误。
答案选C。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制取干燥的氨气:

(1)实验室制备氨气化学方程式是_______________________________。
(2)工业制备氨气的化学方程式是_____________________________________________。
(3)若想制得干燥的氨气,应选择装置_______(填“甲”“乙”或“丙”),不能用乙装置干燥氨气的原因_______________________________(用化学方程式表示)。
(4)检验试管C中氨气收集满的方法是______________________。
(5)试管口放置棉花的作用是_________________________________________。
(6)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。

A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2![]() 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
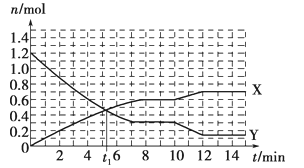
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,28g由C2H4和C3H6组成的混合气体所含原子数为6NA
B. 由0.1mol双氧水参加反应生成氧气,转移的电子总数一定为0.2NA
C. 0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同
D. 2.4gT218O所含中子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料。某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。回答下列有关问题。
(背景素材)Ⅰ.NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2;
II.亚硝酸具有一定的氧化性和还原性,酸性条件下:Ca(NO2)2能将I-氧化为I2;
Ⅲ.I2+2S2O32—=2I-+S4O62—
(制备Ca(NO2)2)该小组设计的制备装置如图所示(夹持装置略去)。
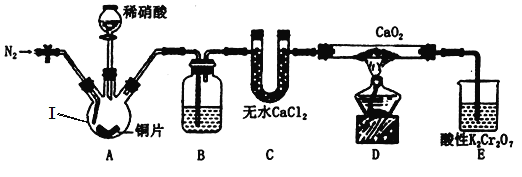
(1)仪器Ⅰ的名称是___________________;B中盛装的试剂是____________________。
(2)制备过程有关操作如下,正确顺序为_______、c、_______、_______、_______、_______。
a.向装置中通入N2 b.向仪器Ⅰ中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入N2 f.关闭分液漏斗旋塞
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3—,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为__________________________。
(4)整个过程持续通N2的作用是______________、_____________、____________。
(测定Ca(NO2)2的纯度)该小组测定产品中Ca(NO2)2纯度的方法如下:a.称取mg产品、溶解、定容至250mL;b.移取25.00mL溶液于锥形瓶中,加入过量的V1 mLc1mol/L的KI溶液并酸化;c.以淀粉为指示剂,用c2mol/L的Na2S2O3溶液滴定。进行三次平行实验,消耗标准液体积平均值为V2 mL。
(5)测定过程所需仪器在使用前必须检查是否漏液的有______________________。
(6)该产品中Ca(NO2)2的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
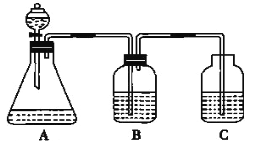
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com