
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
分析 A.反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu;
B.而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+;
C.发生反应:Fe+Fe2O3+6HCl=3FeCl2+3H2O、Fe+CuO+2HCl=FeCl2+Cu+H2O、Fe+2HCl=FeCl2+H2↑,根据方程式判断;
D.参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,计算混合物中O原子物质的量,根据Cu元素守恒计算n(CuO),再根据O原子守恒计算n(Fe2O3);发生的反应中Fe失电子,Fe2O3、CuO和部分盐酸得电子,根据转移电子守恒得2n(Fe)=2n(Fe2O3)+2n(CuO)+2n(H2),即n(Fe)=n(Fe2O3)+n(CuO)+n(H2),然后根据m=nM计算.
解答 解:A.反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,故A正确;
B.而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,故B错误;
C.发生反应:Fe+Fe2O3+6HCl=3FeCl2+3H2O、Fe+CuO+2HCl=FeCl2+Cu+H2O、Fe+2HCl=FeCl2+H2↑,由方程式可知原混合物中n(Fe)>n(Fe2O3)+n(CuO),故C错误;
D.反应后剩余n(H+)=0.4mol/L×0.2L=0.08mol,原溶液中n(HCl)=4.4mol/L×0.1L=0.44mol,参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即:2n(H2O)+2×$\frac{0.896L}{22.4L/mol}$=0.44mol-0.08mol,n(H2O)=0.14mol,故混合物中n(O)=n(H2O)=0.14mol,由铜元素守恒,则n(CuO)=n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,由O原子守恒:3n(Fe2O3)+n(CuO)=0.14mol,则n(Fe2O3)=0.04mol;反应中Fe失电子,Fe2O3、CuO和部分盐酸得电子,根据转移电子守恒得:2n(Fe)=2n(Fe2O3)+2n(CuO)+2n(H2),即n(Fe)=n(Fe2O3)+n(CuO)+n(H2),xmol=0.04mol+0.02mol+0.04mol,x=0.10mol,则m(Fe)=nM=0.10mol×56g/mol=5.60g,故D错误;
故选A.
点评 本题考查混合物反应的计算,题目难度中等,侧重考查学生分析计算能力,注意从溶液存在的离子判断物质反应的程度,注意利用守恒法与总方程式解答,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  干燥Cl2 | |
| B. |  配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③⑥⑤⑥ | B. | ②⑥③⑥⑤⑥ | C. | ①⑥④⑥⑤⑥ | D. | ②⑥④⑥⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | CH3CH2OH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
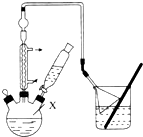 对叔丁基苯酚
对叔丁基苯酚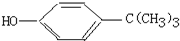 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51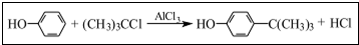 .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:  | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com