【答案】
分析:(1)除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:
①从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;
②除去海水中的盐分,有电渗拆法、离子交换法和压渗法;
(2)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠;如果氯气遇到氢氧化钠溶液可反应生成次氯酸钠;
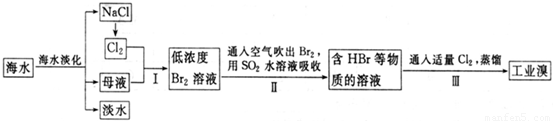
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)SO
2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.由于此反应有强酸HBr和H
2SO
4生成,易腐蚀设备,顺利写出工业生产需要解决的问题;
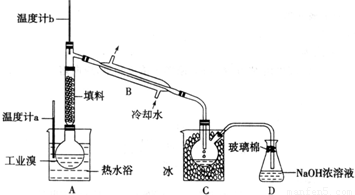
(5)工业制溴中提纯溴的方法,主要是利用蒸馏方法,由于Br
2具有强氧化性,易把橡胶塞和橡胶管氧化腐蚀,所以不用橡胶塞和橡胶管;由于题干中给出信息Br
2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;C中液体为冷凝下来的纯溴,则颜色为深棕红色,除去该产物中仍残留的少量Cl
2,加入NaBr溶液,和氯气反应生成氯化钠和溴单质,达到除去氯气的目的,充分反应后,用蒸馏的方法得到.
解答:解:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法,除去海水中的盐分,有电渗拆法、离子交换法和压渗法,
故答案为:蒸馏法、电渗析法、离子交换法等中的一种;
(2)电解NaCl溶液:2NaCl+2H
2O

2NaOH+Cl
2↑+H
2↑,若产生的Cl
2直接与溶液中NaOH反应,可以生产消毒液NaClO,
故答案为:Cl
2;NaOH;NaClO;
(3)步骤Ⅰ中已获得Br
2,步骤Ⅱ中又将Br
2还原为Br
-,目的是低浓度的Br
2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)二氧化硫吸收溴单质发生反应,SO
2+Br
2+2H
2O=H
2SO
4+2HCI,离子方程式为SO
2+Br
2+2H
2O═4H
++2Br
-+SO
42-,环境保护主要是减少SO
2气体的损耗和排放,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,
故答案为:SO
2+Br
2+2H
2O═4H
++2Br
-+SO
42-;强酸对设备的严重腐蚀;
(5)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,故答案为:冷凝管;
②控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,同时避免污染环境,最后进行尾气吸收,由于溴单质是一种强氧化剂,易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,故答案为:Br
2腐蚀橡胶;
③达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,故答案为:控制温度计b的温度,并收集59℃时的馏分;
④该产物中仍残留的少量Cl
2,加入NaBr溶液发生反应:2NaBr+Cl
2=2NaCl+Br
2,可以除去氯气,生成的溴单质可以用蒸馏的方法得到,故答案为:深红棕色;蒸馏.
点评:本题考查了海水资源的综合利用,海水提溴工艺,烧碱工业流程,实验基本操作.

 2NaOH+Cl2↑+H2↑,若产生的Cl2直接与溶液中NaOH反应,可以生产消毒液NaClO,
2NaOH+Cl2↑+H2↑,若产生的Cl2直接与溶液中NaOH反应,可以生产消毒液NaClO,