
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用FeCl3溶液腐蚀铜箔制作印刷电路板:Fe3++Cu=Cu2++Fe3+
B. 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4![]() CaCO3+SO42-
CaCO3+SO42-
C. 碳酸钠溶液显碱性:CO32-+2H2O=HCO3-+2OH-
D. 用NaOH溶液吸收氯气:Cl2+2OH-=2Cl-+H2O
【答案】B
【解析】分析:A.根据电荷守恒判断,该离子方程式两边正电荷不守恒;B.碳酸钙溶解性小于硫酸钙,硫酸钙沉淀转化成更难溶的碳酸钙沉淀;C.碳酸钠溶液中,碳酸根离子水解,溶液显示碱性,碳酸根离子的水解分步进行;D.氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠和水。
详解:A.用FeCl3溶液腐蚀铜箔制作印刷电路板,铁离子与铜反应生成铜离子和亚铁离子,离子方程式必须遵循电荷守恒,正确的离子方程式为:2Fe3++Cu═Cu2++2Fe2+,故A错误;B.用Na2CO3溶液处理水垢中的CaSO4,微溶物硫酸钙转化成更难溶的碳酸钙沉淀,反应的离子方程式为:CO32-+CaSO4![]() CaCO3+SO42-,故B正确;C.碳酸钠溶液显碱性,碳酸根离子的水解分步进行,离子方程式中应该分步写,主要写出第一步即可,正确的水解方程式为:CO32-+H2O═HCO3-+OH-,故C错误;D.NaOH溶液吸收氯气,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故D错误;故选B。
CaCO3+SO42-,故B正确;C.碳酸钠溶液显碱性,碳酸根离子的水解分步进行,离子方程式中应该分步写,主要写出第一步即可,正确的水解方程式为:CO32-+H2O═HCO3-+OH-,故C错误;D.NaOH溶液吸收氯气,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故D错误;故选B。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠镁原子核外有____种不同运动状态的电子,____种不同能量状态的电子.
㈡A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为_____
(2)B元素的负一价离子的电子层结构与氩相同,B的原子结构示意图为_____
(3)C元素是第三周期中无未成对电子的主族元素,它的电子排布图为_____
(4)D元素基态原子的M层全充满,N层有一个电子,D基态原子的电子排布式为_____
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期表中所处的周期数和族序数_____
㈢.用符号“>”“<”或“=”连接下列各项关系.
(1)第一电离能:N_____O,Mg_____Ca.
(2)电负性:O_____F,N_____P.
(3)能量高低:ns_____np,4s_____3d.
查看答案和解析>>
科目:高中化学 来源: 题型:
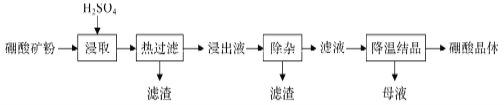
【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
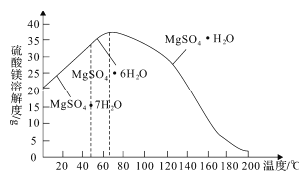
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,D相对分子质量比C相对分子质量大16,E是强酸,当X无论是强酸还是强碱时都有如下转化关系。当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素。下列说法一定不正确的是( )
![]()
A. D和H2O反应生成E不是氧化还原反应
B. 当X是强碱时,E是HNO3;当X是强酸时,E是H2SO4
C. 当X是强酸时,C在常温下是气态单质
D. A为硫化铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A.Ba2+、NH4+、Cl-、CO32-B.Na+、HCO3-、H+、NO3-
C.Ba2+、NO3-、Cl-、Na+D.K+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com