
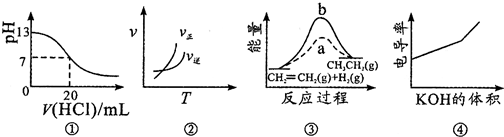
| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
分析 A、酸碱中和的时候pH会突变;
B、对于可逆反应A2(g)+3B2(g)?2AB3(g)(△H<0),反应放热,升高温度,正逆反应速率都增大,平衡向逆反应方向移动;
C、图象中使用催化剂降低反应活化能,但反应是放热反应,反应物能量高;
D、溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入KOH后,溶液中离子浓度增大,溶液导电性增强.
解答 解:A、用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故A错误;
B、反应放热,升高温度,正逆反应速率都增大,正反应速率增大的倍数比逆反应速率小,平衡向逆反应方向移动,故B错误;
C、图象中使用催化剂降低反应活化能,但反应是放热反应,反应物能量高,图象中表示的吸热反应,故C错误;
D、溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入KOH后,溶液中离子浓度增大,溶液导电性增强,故D正确;
故选D.
点评 本题考查了化学反应能量变化,影响溶液导电性判断,图象分析方法和平衡移动原理的判断依据是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O | D. | Na2O+H2O═2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比纯铝熔点高 | |
| B. | 各种成分在自然界中含量丰富,容易获取 | |
| C. | 具有比较活泼的化学性质 | |
| D. | 质量轻,强度大,抗腐蚀能力比较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2AgNO3+BaCl2═2AgCl↓+Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
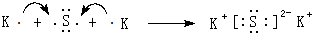 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com