
 ,故答案为:S;
,故答案为:S; ;
;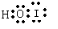 ,故答案为:分子;极性;IBr+H2O=HBr+HIO;
,故答案为:分子;极性;IBr+H2O=HBr+HIO;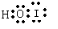 .
.


科目:高中化学 来源: 题型:
| A、υ(A)=0.5 mol/(L?s) |
| B、υ(B)=0.3 mol/(L?s) |
| C、υ(C)=18 mol/(L?min) |
| D、υ(D)=1 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
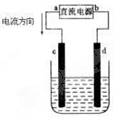 电解CuCl2溶液装置如图:(用惰性电极)电源的正极为
电解CuCl2溶液装置如图:(用惰性电极)电源的正极为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaBH4既是氧化剂又是还原剂 |
| B、NaBH4是氧化剂,H2O是还原剂 |
| C、硼元素被氧化,氢元素被还原 |
| D、被氧化的元素与被还原的元素质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
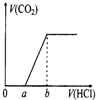 在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )
在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )| A、若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+=HCO3- |
| B、若a:b>l:2,且b=20 mL,则原NaOH溶液的浓度为0.02 mol/L |
| C、若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D、a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水→在人体内调节酸碱度的主要物质 |
| B、油脂→发生水解反应得到氨基酸和甘油 |
| C、蔗糖→与氢氧化铜悬浊液反应生成砖红色沉淀 |
| D、纤维素→发生水解反应最终生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
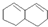 在较高温度下和Br2按物质的量之比1:1发生加成反应的方程
在较高温度下和Br2按物质的量之比1:1发生加成反应的方程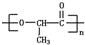 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为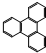 的一氯取代物有
的一氯取代物有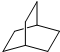 的二氯取代物有
的二氯取代物有查看答案和解析>>
科目:高中化学 来源: 题型:
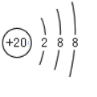
A、Na+的结构示意图: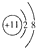 |
B、水分子的电子式: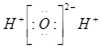 |
| C、二氧化碳的结构式:O=C=O |
| D、硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com