
|
下列溶液中,溶质的物质的量浓度为1 mol/L的是 | |
| [ ] | |
A. |
将40 g NaOH溶于1 L水所得的溶液 |
B. |
将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水所得的溶液 |
C. |
将31 g Na2O溶于水并配成1 L的溶液 |
D. |
含K+为0.5 mol/L的K2SO4溶液 |
科目:高中化学 来源: 题型:
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
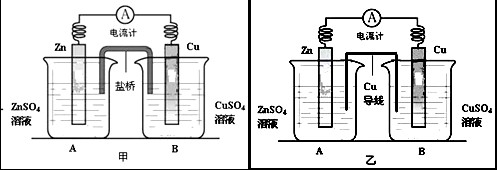
查看答案和解析>>
科目:高中化学 来源: 题型:
 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-查看答案和解析>>
科目:高中化学 来源:2013届福建省南安一中高三上学期期末考试化学试卷(带解析) 题型:实验题
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
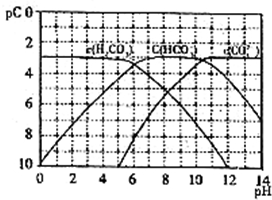
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |

 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期期末考试化学试卷(解析版) 题型:实验题
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)

①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
A.变大 B.变小 C.基本不变 D.无法判断
(2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,

该电池反应的离子方程式为 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
;
CH3OH(g) +H2O(g) △H
;
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH 0(填“>” “<”或“=”)。

②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
|
容 器 |
甲 |
乙 |
|
反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com