
【题目】某溶液中含有大量的Cl﹣、Br﹣、I﹣ , 若向1L该混合溶液中通入一定量的Cl2 , 溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为( )
Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
n(Cl﹣)/mol | 1.5 | 2.0 | 3.0 |
n(Br﹣)/mol | 3.0 | 2.8 | 1.8 |
n(I﹣)/mol | x(x>0) | 0 | 0 |
A.5:15:4
B.5:12:4
C.15:30:8
D.条件不足,无法计算
【答案】A
【解析】解:还原性:I﹣>Br﹣,加入氯气5.6L时溶液中I﹣为xmol,则说明通入5.6L Cl2只发生:Cl2+2I﹣═I2+2Cl﹣,由表中数据可知原溶液中溴离子为3mol,
通入11.2L氯气,其物质的量为 ![]() =0.5mol,I﹣为0mol,碘离子完全反应,同时氧化0.2mol溴离子,发生反应:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,氯气反应生成的氯离子为0.5mol×2=1mol,故原溶液中氯离子为2mol﹣1mol=1mol,
=0.5mol,I﹣为0mol,碘离子完全反应,同时氧化0.2mol溴离子,发生反应:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,氯气反应生成的氯离子为0.5mol×2=1mol,故原溶液中氯离子为2mol﹣1mol=1mol,
由方程式可知溶液中阴离子总的物质的量不变(不含氢氧根离子),故原溶液中碘离子的物质的量为2mol+2.8mol﹣1mol﹣3mol=0.8mol,
故原溶液中Cl﹣、Br﹣、I﹣物质的量之比为1mol:3mol:0.8mol=5:15:4,
故选:A.


科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成: 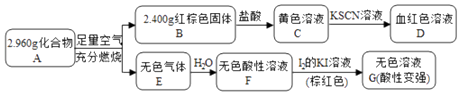
请回答:
(1)A的化学式为 . A煅烧生成B和E的化学方程式为 .
(2)溶液C可溶解铜片,反应的离子方程式为 , 例举该反应的一个实际应用是
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g/L),该气体分子的电子式为 . 该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3 , Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 , 该元素的符号是 .
(2)Y元素原子的价层电子的轨道表示式为 .
(3)X与Z可形成化合物XZ3 , 该化合物的空间构型为 .
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低 , 理由是 .
(5)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3 , 产物还有ZnSO4和H2O,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B均由C、H、O三种元素组成,A、B互为同分异构体,均在酸性条件下水解,且均只生成两种有机物.下列说法正确的是( ) 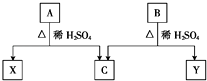
A.X、Y一定互为同系物
B.X、Y的通式一定不相同
C.X、Y一定互为同分异构体
D.X、Y可能互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料.请回答:
(1)基态V原子的价层电子排布式为;其中能量最高的电子所占用能级的原子轨道有个伸展方向.
(2)VO2+与  可形成配合物.
可形成配合物.  中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
中,三种非金属原子的第一电离能由大到小的顺序为(用元素符号表示);C原子的杂化轨道类型为 .
(3)镍形成的Ni(NH3)62+、Ni(CN)42﹣中,NH3分子中N原子的价层电子对数目为 . 写出一种与CN﹣互为等电子体的分子的化学式: .
(4)La﹣Ni合金是重要的储氢材料,储氢后的晶胞如图所示.①合金中,1个La原子周围距离最近切相等的La原子数目为
②含有1molNi原子的合金中储存H2的物质的量为 . 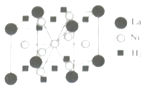
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于淀粉的认识中,不正确的是 ( )
A.淀粉属于糖类,有甜味
B.淀粉属于高分子化合物
C.淀粉与碘水作用呈现蓝色
D.淀粉在人体内能够水解,生成葡萄糖,经肠壁吸收进入血液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com