
| A. | 按系统命名法,有机物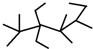 的命名为2,2,4,4,5-五甲基-3,3-二乙基庚烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基庚烷 | |
| B. | 乙醇发生消去反应、乙醇氧化为乙醛、乙酸的酯化反应中均是C-O键发生断裂 | |
| C. | C3H6和C4H8在分子组成上相差CH2,所以二者互为同系物 | |
| D. | 荧光黄结构为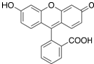 ,其分子式为C20H12O5,其中最多有9个碳原子共平面 ,其分子式为C20H12O5,其中最多有9个碳原子共平面 |
分析 A.键线式中短线表示化学键,交点、端点为C原子,利用H原子以及碳的四价结构,结合系统命名法命名;
B.乙醇催化氧化生成乙醛,断键为O-H键、羟基相连碳原子上的C-H;
C、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
D.结构结构简式书写分子式,利用苯环、C=C双键的平面结构分析,注意单键可以旋转.
解答 解:A.有机物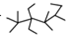 的命名为:2,2,4,4,5-五甲基-3,3-二乙基庚烷,故A正确;
的命名为:2,2,4,4,5-五甲基-3,3-二乙基庚烷,故A正确;
B.乙醇消去反应,断开C-O键以及与羟基相连的碳原子相邻的碳原子上的C-H键,乙醇催化氧化生成乙醛,断键为O-H键、羟基相连碳原子上的C-H,乙酸酯化反应断C-O键,故B错误;
C、C3H6和C4H8可以是环烷烃也可以是烯烃,故两者不一定是同系物,故C错误;
D.荧光黄结构为 ,其分子式为C20H12O5,分子中含有苯环、C=C双键形成的平面构成平面结构,通过旋转连接苯环的C-C单键,可以使所以的碳原子处于同一平面内,故D错误;
,其分子式为C20H12O5,分子中含有苯环、C=C双键形成的平面构成平面结构,通过旋转连接苯环的C-C单键,可以使所以的碳原子处于同一平面内,故D错误;
故选A.
点评 本题考查有机物的结构与性质、有机物的命名、官能团的结构与性质,难度较大,选项D为易错点、难点,对学生的空间想象,具有较高的要求.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔融态的A中阴离子有2种 | |
| B. | C溶于水会促进水的电离 | |
| C. | 将A溶液滴入B溶液中,能使B溶液中阳离子浓度增大 | |
| D. | B溶液的焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | CH3CH2OH+CH3C00H$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2═CH2+Br2→BrCH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空: 或
或 .
. .
. 与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为
与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由A生成对溴苯乙烯的反应条件为浓硫酸、加热.
.由A生成对溴苯乙烯的反应条件为浓硫酸、加热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO在反应中作还原剂 | |
| B. | 氧化剂和还原剂的物质的量比为1:3 | |
| C. | FeCl2发生还原反应 | |
| D. | 0.5molFeCl2发生反应,转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第ⅠA族元素比第ⅡA族元素的金属性强 | |
| C. | 随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱 | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com