
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| 0.5×0.5 |
| 0.12 |
| c(N2)c(O2) |
| c2(NO) |
| 0.1×0.1 |
| 0.22 |
| 1 |
| k |
| 1 |
| 25 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等物质 |
| B、向CuSO4溶液中滴入过量的氨水,最终可得到深蓝色的溶液 |
| C、检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 |
| D、将铝箔打磨后置于置于酒精灯火焰上加热,铝箔会点燃,产生耀眼的白光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
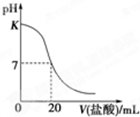 在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
在25℃时,用0.125mol?L-1的标准盐酸滴定25.00mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )| A、13 | B、12 | C、10 | D、11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,正反应速率等于逆反应速率 |
| B、增大氢气的浓度可增大反应速率 |
| C、在上述条件下,氢气能全部转化为碘化氢 |
| D、达到平衡时,体系中各物质的质量分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | 1.50 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.67 | 0.61 | 0.56 | 0.20 | 0.56 | 0.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应生成的次氯酸具有强氧化性,可用于漂白 |
| B、二氧化硅的化学性质很不活泼,不能与强碱反应生成盐 |
| C、金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
| D、钠与硫酸铜溶液反应,可以置换出铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com