
| A、将含0.1mol/L的氯化铁饱和溶液滴入沸水中形成的胶体粒子数目小于0.1NA |
| B、纳米材料微粒直径一般从几纳米到几十纳米.因此纳米材料属于胶体 |
| C、往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 |
| D、水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |


科目:高中化学 来源: 题型:
| A、把镁粉投入氯化铁溶液中,常温下不会有氢气放出 |
| B、工业上通常用煅烧菱镁矿来制取氧化镁 |
| C、镁的主要用途是用于制造合金和照明弹 |
| D、食盐中如含氯化镁就易潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时电池内部Li+向负极移动 |
| B、电池的负材料为Li |
| C、放电过程中,电池正极材料发生氧化反应 |
| D、充电时阴极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
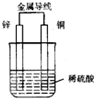 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol NO2中含有的分子数为 NA |
| B、常温常压下,0.2mol铁在0.2 mol氯气中充分燃烧,转移的电子数为 0.6NA |
| C、7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
| D、11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
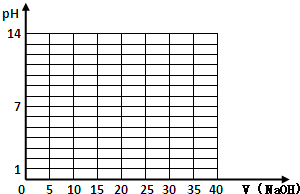
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com