
已知X和Y是两种单质,X+Y→X2++Y2- ,现有下列叙述正确的是: ①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
某工厂废液经测定得知主要含有乙醇,其中还有丙酮、乙酸和乙酸乙酯,根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃时的馏出物;④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收馏出物,请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是
________________________________________________________________________
________________________________________________________________________。
(2)在70℃~85℃时馏出物的主要成分是__________________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表
示)________________________________________________________________________
________________________________________________________________________。
(4)当最后蒸馏的温度控制在85℃~125℃一段时间后,耐酸蒸馏器残液中溶质的主要成分是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
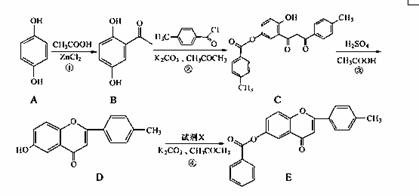
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)写出反应①的化学方程式 。
(6)已知: 。
。
根据已有知识并结合相关信息,写出以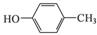 和CH3COOH为原料制备
和CH3COOH为原料制备
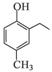 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
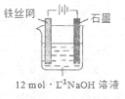
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O 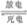 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
、三氟化氮(NF3)是无色无味气体,它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F。下列说法正确的是
A、NH4F的还原性比NH3强
B、NF3的氧化性比F2强
C、该反应中被氧化和被还原物质的物质的量之比为4∶3
D、该反应中得到1 mol NF3时,转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
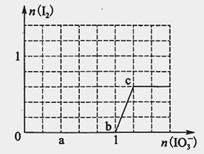
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
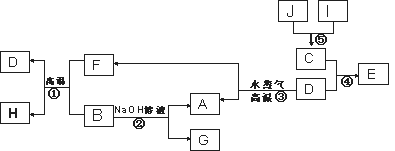
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有:( )
A.32 B.16 C.8 D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com