
【题目】在5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,氧化剂与还原剂物质的量之比是
2HNO3+4N2↑+9H2O反应中,氧化剂与还原剂物质的量之比是
A. 5∶8 B. 5∶4 C. 5∶3 D. 3∶5
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是

选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:

已知:RCN在酸性条件下发生水解反应:RCN![]() RCOOH
RCOOH
(1)C的分子式为_______________,D→E的反应类型是________________。
(2)F分子中有3个含氧官能团,名称分别为醚键、羧基和______________。
(3)写出A→B 的化学方程式:__________________________________。
(4)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为________________。
(5)写出符合下列条件的D的一种同分异构体的结构简式:________________。
①分子中有4种不同化学环境的氢;
②可发生水解反应,且一种水解产物能与FeCl3发生显色反应,另一种水解产物能发生银镜反应。
(6)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体。写出以
)是一种重要的医药中间体。写出以![]() 和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _______。
_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
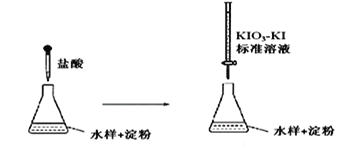
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
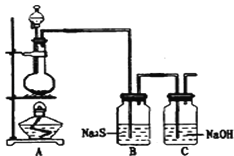
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是:
A. NH3 + HCl = NH4Cl B. CuO + H2![]() Cu + H2O
Cu + H2O
C. CaCO3 ![]() CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
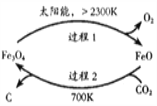
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1molCO2转移电子的物质的量是_________。
②过程2反应的化学方程式是__________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
按投料比n(CO2) : n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
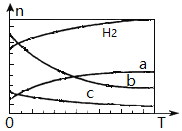
①正反应的焓变△H_______0 。
②提高CO2的转化率,可采用的方法是_______。
A.减小n(CO2)与n(H2)的投料比
B.改变催化剂
C.缩小容器体积
③图中表示乙烯的曲线是_______。
(3)以NH3与CO2为原料,合成尿素[化学式:CO(NH2)2]:
反应如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2与NH3形成液态水时,合成尿素的热化学方程式是_______________;
(2)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极,将CO2转化为丙烯的原理模型。
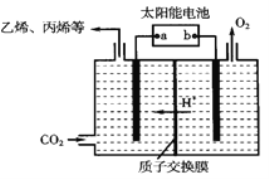
①太阳能电池的负极是_________。
②生成丙烯的电极反应式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com