
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 浓度相等的CH3COOH溶液与NaOH溶液混合后显中性,c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |
分析 A.如果溶液中溶质是NaOH、CH3COONa且二者浓度相等时,则存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
B.混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
C.常温下pH=2的醋酸浓度大于0.01mol/L、pH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合醋酸有剩余,混合溶液中常数电离导致溶液呈酸性,结合电荷守恒判断;
D.将pH=8.5的氨水加水稀释导致溶液浓度降低,溶液的pH降低,c(OH-)减小但c(H+)增大.
解答 解:A.如果溶液中溶质是NaOH、CH3COONa且二者浓度相等时,钠离子不水解浓度最大,醋酸根离子水解生成氢氧根离子、NaOH电离生成氢氧根离子,溶液呈碱性,则存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A正确;
B.混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),故B错误;
C.常温下pH=2的醋酸浓度大于0.01mol/L、pH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合醋酸有剩余,混合溶液中常数电离导致溶液呈酸性,则c(OH-)<c(H+),结合电荷守恒得c(Na+)<c(CH3COO-),醋酸电离程度较小,所以溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.将pH=8.5的氨水加水稀释导致溶液浓度降低,溶液的pH降低,c(OH-)减小但温度不变离子积常数不变,则c(H+)增大,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,侧重考查学生分析判断能力,注意电荷守恒、物料守恒的利用运用,注意D中除了c(H+)外其它微粒浓度都减小,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
. ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
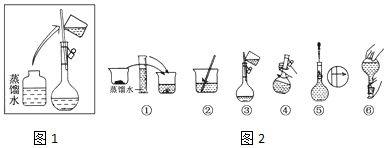
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应是指在同一条件下能同 时向正逆两个方向进行的反应 | |
| B. | 2HI$\stackrel{△}{?}$H2+I2是可逆反应 | |
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O与2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑互为可逆反应 | |
| D. | 只有可逆反应才存在化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氢气分子所占的体积为22.4L | B. | 2NA个二氧化碳分子的质量为44g | ||
| C. | 32g O2所含的氧原子数目是2NA | D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L0.5mol/L Na2SO4溶液中含NA个Na+ | |
| B. | 在常温常压下,1molHe含有的原子数为2NA | |
| C. | 2gH2所含原子数为NA | |
| D. | 在常温常压下,11.2L氮气含有的分子数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 可将地下钢管与外加直流电源的负极相连以保护它不受腐蚀 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 电解MgCl2溶液,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com