
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,空间构型 。
②基态W原子的核外电子排布式 。
③Y、Z、M三种元素的第一电离能由大到小的顺序为 (用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g) △H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g) △H=+180.5kJ·mol-1
则上述反应的热化学方程式是 。
(13分)(1)①3s23p63d5;②x=5;分子晶体;
(2)立方体;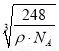 ;
;
(3)①sp杂化 ;直线形;②1s22s22p63s23p63d104S1
③N>O>C;NH3分子间存在氢键;④N2O;
⑤2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol(2分)
【解析】
试题分析:(1)①Fe为26号元素,原子核外电子排布为1s22s22p63s23p63d64s2,失3个价电子后,基态Fe3+电子排布式为1s22s22p63s23p63d5 ,那么M层电子排布式为:3s23p63d5;
②Fe(CO)x的中心原子Fe的价电子数为3d64s2共8个,每个配体提供2个电子,则8+2x=18,解得x=5,由已知,该配合物熔点为 -20.5℃,沸点为103℃,熔沸点较低、易溶于非极性溶剂,为分子晶体的性质,故为分子晶体。
(2)由图可得:距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,
由均摊法:该晶胞中钠离子个数是8,氧离子个数=8×1/8+6×1/2=4,也就是说每个晶胞中有4个Na2O,则晶胞体积V=[(4×62)/ρNA]cm3,所以a=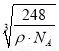 cm
cm
(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素是H元素,Y原子基态时最外层电子数是其内层电子数的2倍,则Y为C元素,Z原子基态时2p原子轨道上有3个未成对的电子,则Z原子电子排布式为1S22S22p3为N元素,M基态原子中s电子数等于p电子数,则M原子电子排布式为1S22S22p4为O元素。W的原子序数为29,则W为Cu。回答下列问题:
①C2H2分子中C原子轨道的杂化类型为SP杂化,空间构型直线形。
②由基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1。
③同周期由左到右第一电离能有增大的趋势,但由于N的2p轨道为半充满状态,所以其第一电离能比相邻的元素要高。故C、N、O三种元素的由于第一电离能由大到小的顺序为N>O>C;
NH3分子间可以形成氢键,故其沸点比CH4的高;
④CO2与N2O原子数,电子数均相等二者互为等电子体;
⑤已知::①COg)+ 1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) △H=+180.5kJ·mol-1
由盖斯定律2×①-②可得2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol
考点:了解原子核外电子排布。掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。能根据晶胞确定晶体的组成及相关计算。


科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
下列物质中属于强电解质的是
A.NH3·H2O B.Cl2 C.NaCl溶液 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是

①中的物质 | ②中的物质 | 预测①的现象 | |
A | 酚酞溶液 | 浓盐酸 | 无明显变化 |
B | 浓硫酸 | 浓氨水 | 冒白烟 |
C | 酚酞溶液 | 浓氨水 | 溶液变红 |
D | 氯化铝溶液 | 浓氨水 | 出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
某溶液中含有的离子是K+、NH4+、Fe2+、Fe3+、A13+、AlO2-、SO42-、CO32-、SiO32-、Cl-、NO3-中的某几种,已知各微粒的浓度均为0.1mol·L-1。现进行如下实验:
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生。
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色。
根据上述实验事实推断,有关该溶液的说法错误的是
A.至少含有4种离子
B.取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀
C.若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+
D.溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
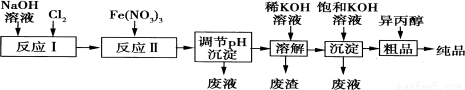
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
关于下列几种离子晶体,说法不正确的是
A.由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,配位数不相等主要是由于F—、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大
D.MCO3中M2+离子半径越大,MCO3热分解温度越低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子立体构型都是正四面体
B.CH4中的sp3杂化轨道是4个H原子的1s 轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一原子中能量相近的s 和p轨道混合形成的一组新轨道
D.凡AB3型的共价化合物,中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:实验题
氨气是重要的化工原料。
38.1.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱 b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气, 。
39.2.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为 ;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入 。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧 b.含碳物质燃烧 c.合成氨厂的副产品
40.3.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;
② [Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因 。
41.4.某实验小组设计了下列装置进行氨的催化氧化实验。
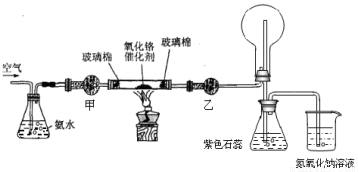
(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为: 、 。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOH g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO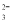 +2H2O
+2H2O
C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO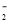 +4NH
+4NH +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com