
| A. | 原子半径:rW<rX<rY | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中,Z的最高价氧化物对应水化物的酸性最强 |
分析 在周期表中X与Y、Z、W紧密相邻,X、Y两元素的原子序数之和等于Z元素的原子序数,所以X和Z属于同一主族且Z在X的下一周期,原子序数不大于18,设X的原子序数是a,所以a+a+1=a+8,a=7,所以X是N元素,Y是O元素,Z是P元素,X、Y、Z、W四种短周期元素的最外层电子数之和为20,所以W是C元素.根据元素所在周期表中的位置结合元素周期律的递变规律解答.
解答 解:X为N、Y为O、Z为P、W为C元素.
A.同周期元素从左到右原子半径逐渐减小,故A错误;
B.碳元素形成的单质有金刚石、石墨、C60等,氮元素形成的单质有氮气,氧元素形成的单质有氧气和臭氧,磷元素形成的单质有红磷和白磷,故B错误.
C.四种元素与氢可形成PH3、N2H4、H2O2、C2H618电子分子,故C正确;
D.非金属性O>N>P>C,O无含氧酸,N的最高价氧化物对应水化物的酸性最强,故D错误.
故选C.
点评 本题考查原子结构和元素周期律关系,为高频考点,侧重考查分析、推断能力,涉及物质结构、基本概念、元素周期律,正确推断元素是解本题关键,知道常见18电子、10电子微粒,题目难度中等,易错选项是C.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L已烷含有的共价键总数为19NA | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移的电子数为2NA | |
| C. | 1L 0.1mol•-1 Na2CO3溶液中CO32-和HCO3-离子数之和为0.1NA | |
| D. | 密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
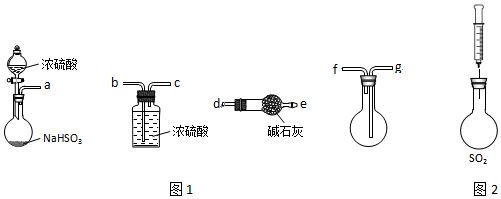
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,NA个H2和O2的混合气体的体积约为22.4 L | |
| B. | 1mol SiO2晶体中,含有2NA个Si-O键 | |
| C. | 0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2 L H2O所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
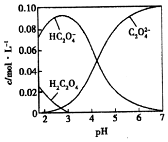 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com