
图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.HI
B.SbH3
C.H2Te
D.SiH4
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下:
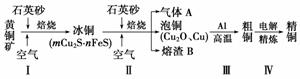
(1)步骤Ⅰ是在反射炉中进行的。把黄铜矿和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是____________________、________________。
(2)步骤Ⅱ是在转炉中发生的。冰铜含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂),在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O 。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的泡铜,该过程发生反应的化学方程式分别是______________________、__________________。气体A中的大气污染物可选用下列试剂中的________吸收(填字母)。
。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的泡铜,该过程发生反应的化学方程式分别是______________________、__________________。气体A中的大气污染物可选用下列试剂中的________吸收(填字母)。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(3)步骤Ⅲ是由泡铜冶炼粗铜的反应,反应方程式为___________________________
________________________________________________________________________
(4)用稀硝酸浸泡熔渣B,取少量所得溶液 ,滴加KSCN溶液后呈血红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是_______________________
,滴加KSCN溶液后呈血红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是_______________________
_________________________________________________________(注明试剂、现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
通过复习总结,你认为下列对化学知识概括合理的是
A.能跟酸反应的氧化物,都是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109°28′
C.有新单质生成的化学反应一定都是氧化-还原反应
D.核外电子总数相同的原子,一定是同种元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子层结构的原子或离子,其对应的元素在周期表中的位置说法正确的是
A.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族
B.3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族
C.最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期
D.原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的A、B、C、D、E、F、G七种前四周期元素(稀有气体除外),常温下,有三种元素对应的单质呈气态,C与D同族。其中A原子核外有六种不同运动状态的电子,C为地壳中含量做多的元素,F的简单离子是同周期主族元素形成的简单离子中氧化性最弱的,G的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)电负性越大的原子,对键合电子的吸引能力越强,通常对应元素化合价呈现负价。根据B、C、D、E四种元素形成的常见化合物的化合价,确定电负性最大的元素,写出其基态原子的电子排布图 。
(2)甲是由B元素等非金属元素组成的离子化合物,甲可由E的氢化物溶液与电解质乙溶液反应生成,写出该反应的离子方程式 。
(3)A元素可形成多种单质,一种晶体结构如图一所示,该晶体与熔融的F单质相互作用,形成某种青铜色的物质(其中的元素F用“●”表示),原子分布如图二所示,该物质的化学式为 。另一种的晶胞如图三所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为___________g·cm-3(保留两位有效数字)。
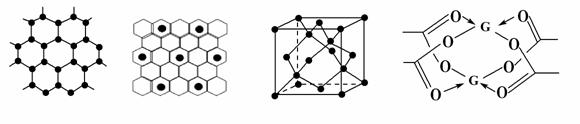 图一 图二 图三 图四
图一 图二 图三 图四
(4)G元素形成的单质,其晶体的堆积模型为________,G的醋酸盐晶体局部结构如图四,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
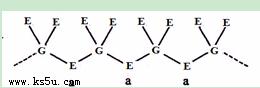
(5)E和F与不同价态的G可组成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均是由G和E两元素形成的无限长链结构(如下图),已知其中一种化合物的化学式为FGE3,另一种的化学式为 。
(6)若物质F2D3是一种含有非极性共价键的离子化合物,各原子最外层都满足8e-稳定结构,请你写出该化合物阴离子的电子式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去)。请按要求回答下列问题:

(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为_______________________________。
(2)若A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ) 的化学方程式为_________________________________________________________________。
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是_________________________________________________________________。
(4)若D为酸或酸性气体,则A、B、C、D可以是________________(请按顺序写出合理的答案)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表中所采取的分离方法与对应原理都正确的是 ( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3中混杂的NaCl | 重结晶 | 氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com