
| A、只有④ | B、只有②③ |
| C、只有③④ | D、全部 |
| 5g |
| (45+5)g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向铝盐溶液中不断滴加氢氧化钠溶液 |
| B、向偏铝酸盐溶液中不断加入盐酸 |
| C、向偏铝酸钠溶液中不断通入二氧化碳气体 |
| D、向氢氧化钠溶液中不断滴加铝盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入NaOH溶液时,原HA溶液中c(H+)=c(OH-)+c(A-) |
| B、向原溶液中滴入少量NaOH溶液,离子浓度可能为:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C、当滴入的NaOH与HA恰好完全中和时,溶液中c(Na+)=c(A-) |
| D、当加入过量的NaOH溶液时,溶液可能呈中性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
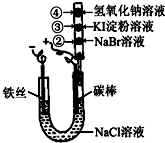 某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )
某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )| A、碳棒的电极反应式为2Cl--2e-=Cl2↑ | ||||
| B、②处、③处白色棉球分别变为橙黄色、蓝色 | ||||
C、如图X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式Mg+Cl2
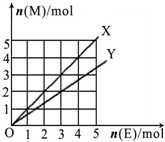 | ||||
| D、在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入3.65gHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | ||
| B、物质的量浓度均为0.01 mol?L-1的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol?L-1 | ||
| C、1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8mol?L-1盐酸的pH=8.0 | ||
D、0.1mol?L-1的醋酸溶液中滴加少量烧碱溶液,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、催化脱氢反应中NH3BH3作氧化剂 |
| B、NH4BO2和NH3BH3含有完全相同的化学键 |
| C、0.1 mol NH3BH3发生催化脱氢反应,可以生成6.72 L H2 |
| D、元素N的第一电离能高于相邻元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、C两种元素可组成化学式为CA3的化合物 |
| B、F与D形成的化合物性质很不活泼,不与任何酸反应 |
| C、原子半径大小顺序是E<F<C<D |
| D、非金属性强弱顺序是D>C>F>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com