
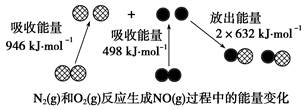
| A��1 mol N2(g)��1 mol O2(g)��Ӧ�ų�������Ϊ180 kJ |
| B��1 mol N2(g)��1 mol O2(g)�����������2 mol NO(g)��������� |
| C��ͨ������£�N2(g)��O2(g)�����ֱ������NO |
| D��NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ |


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ϡ����ķ�Ӧ |
| B�����ȵ�ľ̿��CO2��Ӧ |
| C�������������е�ȼ�շ�Ӧ |
| D��Ba(OH)2��8H2O������NH4Cl����ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Է������������ݣ��Ʋ��Ҵ��ͱ���е����Ըߵ� |
| B�������ܽ�ȵ����ݣ�ѡ�����ؽᾧ�ķ����ɽ��ֱ������ᴿ |
| C�����ݷе�����ݣ��ж��÷���ķ�����ʯ���л�ȡ���ͺ�ú�͵� |
| D������ȼ���ȵ����ݡ��Ȼ�ѧ����ʽ��˹���ɣ��ɼ���һЩ��Ӧ�ķ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��2C====2A+B����H��0 |
| B��2A+B====2C����H��0 |
| C��2C(g)="===" 2A(g)+B(g)����H��0 |
| D��2A(g)+B(g)====2C(g)����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)����H����92��0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ) ( )
2NH3(g)����H����92��0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ) ( ) | A��һ��С��92��0 kJ | B��һ������92��0 kJ |
| C��һ������92��0 kJ | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaOH���� | B�����Һ | C��NaCl����Һ | D��H2O����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ��棩 | |
| 500 | 800 | ||
��2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
��3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com