
| A. | 反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL 0.50mo1•L-1的硫酸充分反应,两反应测定的中和热是相等的 | |
| D. | 在101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |
分析 A、根据反应物和生成物的能量大小可以判断反应的吸放热;
B、一个化学反应发生的条件与反应的热效应无关;
C、中和热均为稀的强酸、强碱反应生成1mol水放出的热量;
D、燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量.
解答 解:A、反应物和生成物所具有的总能量决定了反应是放热还是吸热,反应物所具有的总能量大于生成物所具有的总能量,则反应是放热的,反之是吸热的,故A正确;
B、放热的反应在常温下不一定很容易发生,如:铝热反应2 Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故B错误;
C、中和热均为稀的强酸、强碱反应生成1mol水放出的热量,则两反应测定的中和热相等,故C正确;
D.符合燃烧热的概念,故D正确.
故选B.
点评 本题考查反应热的概念及燃烧热的定义,难度不大,注意放热反应在常温下不一定容易发生,如铝热反应.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为Cl2>Br2>KBrO3>KClO3 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 反应③中1 mol KBrO3参加反应时有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 1mol | NA | |
| B | 22.4L | 1mol | |
| C | 212g | 1mol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
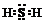 .
.| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
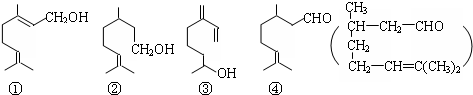
| A. | ④是②的氧化产物 | B. | ①③互为同系物 | ||
| C. | ②③均属于烯烃 | D. | ③④均能发生消去、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
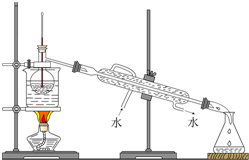 按要求写出下列化学方程式:
按要求写出下列化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
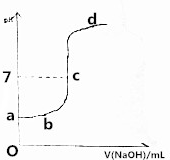 在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:
在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com