
| A.直线形 | B.平面正方形 | C.正四面体形 | D.正八面体形 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
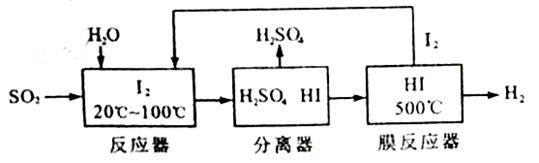
 土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为: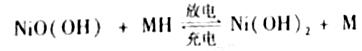
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物中阳离子只能是金属阳离子 |
B.离子键与非极性共价键不可能存 在同一种化合物中 在同一种化合物中 |
| C.共价化合物中可能存在离子键 |
| D.离子键和共价键的实质都是静电作用力 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.简单离子 An+核外有x个电子,A的质量数可表示为2(x+n)? An+核外有x个电子,A的质量数可表示为2(x+n)? |
| B.Z为元素的某同位素En-,核外共有x个电子,又知此同位素原子质量数为A,则其原子核内的中子数为A-x-n? |
| C.A元素的原子质量数为70,核内中子数为39,它的离子有28个电子,A元素氧化物的化学式为AO |
| D.跟9 g水中所含中子数相同的D2O的质量为8 g? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com