
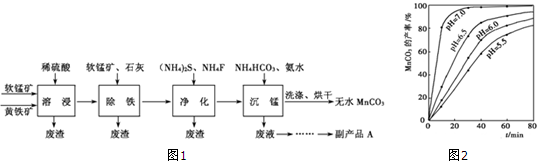
分析 (1)根据影响固体溶解的因素分析,提高溶浸工序中原料的浸出效率是为了加快固体溶解;
(2)根据得失电子守恒、原子守恒和电荷守恒分析配平书写离子方程式,元素化合价变化,铁元素从+2价变化为铁离子,硫元素从-1价变化为+6价,二氧化锰做氧化剂,锰元素化合价从+4价变化为+2价,电荷守恒和原子守恒配平缺项物质和系数;
(3)根据MnCO3的产率与溶液pH、反应时间关系图可知,pH值越大,MnCO3的产率越高;
(4)根据Ksp(CaF2)和c(F-),写出溶度积常数表达式求算钙离子浓度;
(5)根据MnCO3的产率与溶液pH、反应时间关系如图分析,纵轴是碳酸锰的产率,横轴为时间,不同PH时的产率变化曲线分析判断,PH越大,产率越大,曲线越陡反应速率越大分析;
(6)根据溶液中含有的离子分析副产品的主要成分为铵盐,可以做氮肥化肥.
解答 解:(1)加入石灰调节溶液的pH使铁离子沉淀完全,在加入石灰调节溶液的pH前,加入适量的软锰矿主要是使二价铁离子氧化为铁离子;
故答案为:使残余Fe2+转化为Fe3+;
(2)已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,则c(Ca2+)=$\frac{Ksp}{{c}^{2}({F}^{-})}$=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$=1.46×10-6mol•L-1,
故答案为:1.46×10-6mol/L;
(3)根据MnCO3的产率与溶液pH、反应时间关系如图可知:pH等于7.0时反应到达平衡所用时间最短,即反应速率最快,且MnCO3产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3产率最高;
(4)溶浸过程中发生的反应生成硫酸根离子,后来又加入了硫化铵、碳酸氢铵,所以产品中含有(NH4)2SO4,可以做化肥;
故答案为:化肥等;
(5)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,根据电荷守恒可知反应物中有H+,根据原子守恒可知生成物有H2O;所以离子方程式配平为:
2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,
故答案为:2;15;28H+;2;15;4;14H2O;
(6)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度;
故答案为:ABCD.
点评 本题以工业流程图为依托,考查了化学式的计算、离子方程式的书写、电极反应式等,题目难度较大,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
 乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如:
乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如: 、
、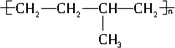 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强反应速率一定增大 | |
| C. | 催化剂V2O5同时改变正逆反应速率 | |
| D. | 增加O2的浓度将提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
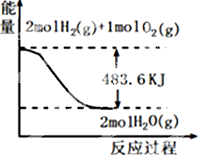
| A. | 表示1mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)的能量低于H2(g)和O2(g)的能量之和 | |
| D. | 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
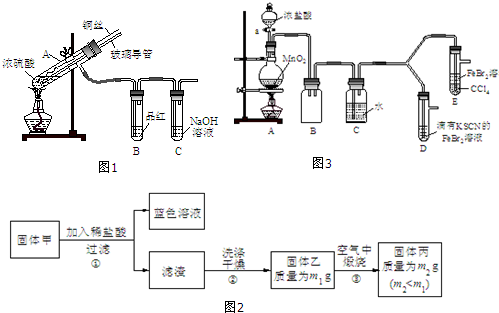
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去保温瓶中的水垢 | B. | 检验自来水中是否含有Cl- | ||
| C. | 检验买来的奶粉中是否加有淀粉 | D. | 洗去白色衣服上的番茄汁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强是开始时的1.5倍 | |
| B. | 容器内A、B、C物质的量浓度之比为2:2:1 | |
| C. | 单位时间消耗0.2 mol A 同时生成0.1 mol C | |
| D. | 容器内各物质的浓度不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com