
����Ŀ����ʹ������к͵ζ����ⶨ�����������������g/100mL����
��ʵ�鲽�裺
��1������ʽ�ζ���ȡ����������Һ20.00mL����ƿ�У������еμ�2��___��ָʾ����
��2����ȡʢװ0.1000mol/LNaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ____mL��
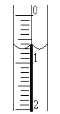
��3���ζ�����___ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��ʵ���¼
�ζ����� ʵ�����ݣ�mL�� | 1 | 2 | 3 | 4 |
V(��Ʒ) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)�����ģ� | 15.95 | 15.00 | 15.05 | 14.95 |
�����ݴ��������ۣ�
��4����ͬѧ�ڴ�������ʱ����ã�
ƽ�����ĵ�NaOH��Һ�����V=(15.95+15.00+15.05+14.95)/4mL = 15.24mL��
ָ�����ļ���IJ�����֮����___������ȷ���ݴ������ɵ�c(��������)=___mol/L��
���𰸡���̪ 0.70 ��Һ����ɫ��Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ ��1���������ϴ�Ӧ���� 0.075
��������
��1����Һ���ᵽ���ɫ����ɫ��Ϊdz��ɫ��
��2���ζ�����Һ����°���λ��0.70mL����
��3�����������һ��NaOH��Һʱ����Һ����ɫ��Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ����ζ��ﵽ�յ㡣
��4�����ݱ������ݣ���1��ʵ������̫��Ӧ�������ã�����c1=c2��V2/V1���㡣
��1����̪�������ᣬ��ҺΪ��ɫ�����������һ��NaOH��Һʱ����Һ�Լ��ԣ���Һ��dz��ɫ���÷�̪��ָʾ��ʱ����Һ��ɫ�仯��dz������ڹ۲죻
��2���ζ�����Һ����°���λ��0.70mL���������Ϊ0.70mL��
��3�����������һ��NaOH��Һʱ����Һ����ɫ��Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ����ζ��ﵽ�յ㡣
��4�����ݱ������ݣ���1��ʵ������̫��Ӧ�������ã�V=(15.00+15.05+14.95)/4=15.00mL������c1=c2��V2/V1=0.1000mol/L��15.00mL/20.00mL=0.075mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�˵����ȷ���ǣ� ��
A.1L0.1molL-1NaNO2��Һ��NO2-����ĿΪ0.1NA
B.3.1g�Ҷ����к����ǻ�����ĿΪNA
C.5.85gNa37Cl��������������Ϊ2.8NA
D.2.4gþ������������N2��O2��ɵĻ����������ȫȼ��ʱ��ת�Ƶĵ�������һ��Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ22.4L(��״��)SO2���塣��ѧС��ͬѧ���ݻ�ѧ����ʽZn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O�����,ȡ65.0gп����98%��ŨH2SO4(��=1.84g/cm3)110mL��ַ�Ӧ,пȫ���ܽ�,�����Ƶõ�����,��ͬѧ��Ϊ���ܻ������ʡ�
(1)��ѧС�����Ƶõ������л��е���Ҫ�������������_______(�����ʽ)���������ֽ������Ҫԭ����_______________________(�û�ѧ����ʽ�ͱ�Ҫ�����ּ���˵��)��
(2)Ϊ֤ʵ��ط���,��ѧС���ͬѧ�����ʵ��,��װ������װ��,������ȡ���������̽����

��װ��B�м�����Լ�_______,��Ӧ�����ӷ���ʽ��______________��
��װ��D������Լ�������_______,װ��F������Լ��Լ�������_______��
�ۿ�֤ʵһ������п����һ������Ũ���ᷴӦ�����ɵ������л���ij���������ʵ��������______________����U�ι�G������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֶ�����Ԫ�������ڱ��е�λ������ͼ��ʾ����X����������븺�۵Ĵ�����Ϊ2��������˵����ȷ��
![]()
A. ԭ�������ɴ�СΪ Z ��Y��X
B. �⻯�����ȶ���Ԫ��ΪZ
C. ����������ˮ����������ǿ��Ԫ��ΪZ
D. ԭ�Ӱ뾶�ɴ�СΪ Y��Z��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ����ȷ����( )
A.������̼��Ʒ�Ӧ��CO32-+2H+=CO2��+H2O
B.����ʯ��ˮ������С�մ���Һ��ϣ�Ca2++OH��+HCO3�� =CaCO3��+H2O
C.��������ˮ��Cl2+H2O![]() 2H++Cl��+ClO-
2H++Cl��+ClO-
D.Ba(OH)2��ϡH2SO4��Ӧ�����ӷ���ʽ��H++OH��=H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������¶���ڿ����У��۲쵽����������������ɫ![]() ��Ұ�
��Ұ�![]() ���ɫ
���ɫ![]() ���泱ʪ
���泱ʪ![]() �γɰ�ɫ����
�γɰ�ɫ����![]() �γɰ�ɫ��ĩ���ݴ��ж�����˵���в���ȷ����( )
�γɰ�ɫ��ĩ���ݴ��ж�����˵���в���ȷ����( )
A.���̢������γɵİ�ɫ��ĩ��![]()
B.���̢�������������Һ���տ����е�![]() ��ˮ�����γ���̼�����ƾ���
��ˮ�����γ���̼�����ƾ���
C.���̢��У�����Ϊ�������ƾ��к�ǿ��ʪ�ԣ����տ����е�ˮ���ӣ�������ȫ�ܽ����Һ
D.�����仯������ֻ��һ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������������ԭ�����͵���
A.����ˮ�д�������ƽ�⣺Br2��H2O![]() HBr��HBrO��������NaOH��Һ����ɫ��dz
HBr��HBrO��������NaOH��Һ����ɫ��dz
B.���ڷ�Ӧ��2HI(g)![]() H2(g)+I2(g)��ʹƽ����ϵ��С�������ѹǿ����ɫ����
H2(g)+I2(g)��ʹƽ����ϵ��С�������ѹǿ����ɫ����
C.Fe(SCN)3��Һ�м������KSCN����ɫ����
D.�غ�ɫ����NO2��2NO2![]() N2O4����С�����ѹ����ɫ�ȱ�����dz
N2O4����С�����ѹ����ɫ�ȱ�����dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ�������
A.���۷���ϡ������Һ��2Fe+6H+�T2Fe3++3H2��
B.��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++OH��![]() NH3��+H2O
NH3��+H2O
C.ʯ��ʯ��ϡ���ᷴӦ��CO32��+2H+�T CO2��+H2O
D.Cl2ͨ��ˮ�У�Cl2+H2O = H++Cl��+HClO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com