
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | ||
B、
| ||
C、
| ||
| D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CS2为V形的极性分子 |
| B、电子云示意图中的每个小黑点都表示一个电子 |
| C、非极性键也可以存在于化合物中 |
| D、甲烷、氨和水都是由极性键结合而成的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol | 放出的热量/kJ |
| 0 | 1.20 | 0.60 | 0 |
| t1 | 0.80 | Q | |
| t2 | 0.20 |

| CO | H2O | CO2 | H2 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0 | 0 |
| 平衡浓度(mol/L) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:


| (1)O3 |
| (2)Zn/H2O |
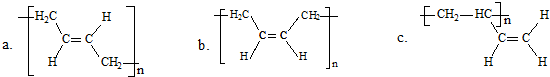
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com