
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1<△H2,故D正确;
故选D.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应属于分解反应、氧化还原反应 | |
| B. | 高氯酸铵属于盐,该反应属于离子反应 | |
| C. | 上述反应瞬间产生的高温气体是推动飞船飞行的主要因素 | |
| D. | 在反应中NH4ClO4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液法可分离植物油和水 | |
| B. | 用过滤法可出去食盐中混有的Fe(OH)3胶体 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用盐酸可除去Mg中混有的Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 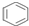 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液显碱性:HS-+H2O?H3O++S2- | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl | |
| D. | 醋酸使碳酸钙溶解:CaCO3+2CH3COOH═Ca 2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com