
【题目】把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5 mol/L
B.4.5 mol/L
C.7.0 mol/L
D.9.0 mol/L
【答案】C
【解析】解:把7.2g纯铁粉投入到40mL某HNO3溶液中,充分反应后剩余固体1.6g,说明生成硝酸亚铁,硝酸完全反应,
参加反应的Fe的质量为:m(Fe)=7.2g﹣1.6g=5.6g,其物质的量为:n(Fe)= ![]() =0.1mol,则生成硝酸亚铁的物质的量为:n[Fe(NO3)2]=n(Fe)=0.1mol,
=0.1mol,则生成硝酸亚铁的物质的量为:n[Fe(NO3)2]=n(Fe)=0.1mol,
反应中硝酸起氧化剂、酸性作用,起酸性作用的酸性生成硝酸亚铁,起氧化剂作用的硝酸生成NO和NO2 , 根据N元素守恒可知该硝酸溶液中含有硝酸的总物质的量为:n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2)=0.1mol×2+0.08mol=0.28mol,
所以原HNO3溶液的物质的量浓度为:c(HNO3)= ![]() =7.0mol/L,
=7.0mol/L,
故选C.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】如图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色.请根据上述信息回答: 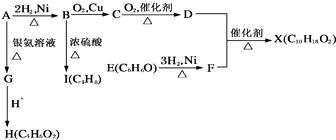
请回答下列问题:
(1)H中含氧官能团的名称是 . B→I的反应类型为 .
(2)只用一种试剂鉴别D、E、H,该试剂是 .
(3)D和F反应生成X的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质是()
A. 胶体粒子不能穿过半透膜,能通过滤纸空隙
B. 胶体粒子带电荷并且在一定条件下能稳定存在
C. 胶体的分散质粒子直径在1 nm~100nm之间
D. 胶体粒子能够发生布朗运动而且能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
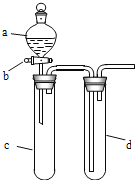
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_______________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是__________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是________,c中加入的试剂是________,d中加入的试剂是________;实验现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq) ![]() Al(OH)3
Al(OH)3 ![]() Al2O3(熔融)
Al2O3(熔融) ![]() Al
Al ![]() Fe
Fe
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③Cu(OH)2CO3 ![]() CuCl2(aq)
CuCl2(aq) ![]() Cu
Cu
④Fe2O3 ![]() FeCl3
FeCl3 ![]() 无水FeCl3
无水FeCl3
⑤饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3 .
Na2CO3 .
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,将合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 , 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1mol
B.合金中,铜的质量为2.8g
C.原硝酸的浓度:c(HNO3)=4.5molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5molL﹣1的NaOH溶液60mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“化学与生活”的说法不正确的是( )
A.硫酸钡可用钡餐透视
B.盐卤可用于制豆腐
C.明矾可用于水的消毒,杀菌
D.醋可用于除去暖水瓶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
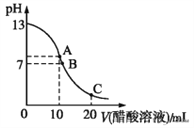
A. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-)
C. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)__________。
(2)X与Y能形成多种化合物,其中相对分了质量是26的分子中,结构式:_______。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
![]() (在水溶液中进行)
(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出D的电子式:______。
①如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式为______。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,由A转化为B的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com