
分析 (1)反应生成MnO4-,故溶液中变成紫红色,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,Mn2+是还原剂,S元素化合价由S2O82-中+7价降低为SO42-中+6价,S2O82-是氧化剂,根据电子转移守恒配平;
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子;
(3)反应中N得到电子同时N失去电子,化合价升高值=化合价降低值=转移电子数=15.
解答 解:(1)反应生成MnO4-,故溶液中变成紫红色,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,Mn2+是还原剂,S元素化合价由S2O82-中+7价降低为SO42-中+6价,S2O82-是氧化剂,由电荷守恒和原子守恒可知,反应方程式为2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,
故答案为:2;5;8;10;2;16H+;
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为: ,
,
故答案为: ;
;
(3)反应中N得到电子同时N失去电子,化合价升高值=化合价降低值=转移电子数=15,电子转移情况如下: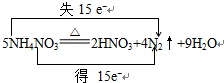 ,
,
故答案为: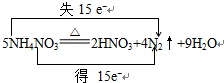 .
.
点评 本题考查氧化还原反应中转移电子数目,为高频考点,把握元素化合价变化及双线桥法表示转移电子的方向和数目为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是治理工业生产对环境产生的污染 | |
| B. | 铁、钙、碘都是人体必不可少的微量元素 | |
| C. | 食盐可作调味剂,但不可作食品防腐剂 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①、②均为氧化还原反应 | |
| B. | 反应①中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 上述尾气N0x的吸收过程中.共转移电子的物质的量为1mol | |
| D. | 上述尾气中NO2与N0的体积比为6:1. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
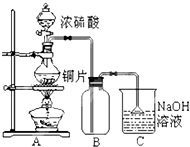 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 | 偏低 | 将硫酸酸化的高锰酸钾溶液换成溴水或碘水或硝酸溶液 |
| 方案② | 不填 | 不填 | 不填 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com