
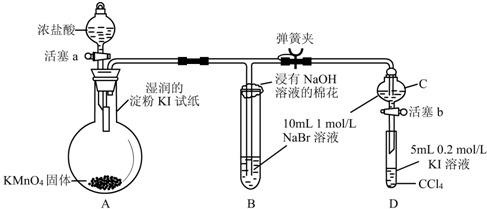
分析 验证卤素单质氧化性的相对强弱:检验气密性,装药品,保持分液漏斗上方与外界空气相同,打开活塞向烧瓶中滴加浓盐酸;装置A:高锰酸钾与浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,湿润的淀粉KI试纸变蓝,说明有单质碘生成,同时也说明氯气氧化性强于单质碘,装置B:氯气与溴化钠反应生成单质溴,在试管中发生反应的离子方程式为Cl2+2Br-═Br2+2Cl-,溶液变棕黄色;B试管口的棉花团的作用吸收多余的氯气,防止污染大气,反应为:Cl2+2NaOH=NaCl+NaClO+H2O,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,打开活塞b,将少量C中溶液滴入D中,关闭活塞b取下D振荡、静止后CCl4层溶液变为紫红色,验证了溴的氧化性强于碘.
(1)高锰酸钾具有强氧化性,与浓盐酸反应生成氯气;
(2)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(3)氯气有毒,不能任意排放,多余氯气需用碱液吸收;
(4)为验证溴的氧化性强于碘,实验时应避免氯气的干扰;
(5)如CCl4层溶液变为紫红色,则说明有碘生成;
(6)从原子结构(电子层数、原子半径)的角度分析.
解答 解:(1)装置A:高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,由电子守恒及质量守恒定律可知,该反应为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;
(2)淀粉变蓝色,说明有单质碘生成,发生反应:Cl2+2I-=I2+2Cl-,氯气为氧化剂,碘单质为氧化产物,氧化剂的氧化性强于氧化产物,所以可说明氯气氧化性强于单质碘,
故答案为:KI淀粉试纸变蓝;Cl2+2I-=I2+2Cl-;
(3)装置B:氯气与溴化钠反应生成单质溴,在试管中发生反应的离子方程式为Cl2+2Br-═Br2+2Cl-,溶液变棕黄色,氯气有毒,多余的氯气不能任意排放,氯气和碱反应生成无毒物质,所以用棉花团吸收多余的氯气,防止污染大气,反应为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:棉花团吸收多余的氯气,防止污染大气;Cl2+2NaOH=NaCl+NaClO+H2O;
(4)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论;
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(5)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,
故答案为:CCl4层溶液变为紫红色;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,非金属性逐渐减弱,
故答案为:非金属性逐渐减弱.
点评 本题考查了卤素单质的性质及检验方法,题目难度中等,注意掌握卤素单质的性质及递变规律,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力和化学实验能力.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、X、Y | |
| B. | 元素非金属性由强到弱的顺序:W、Z、Y | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Ag+ NO3- Cl- | B. | Mg2+NH4+ NO3- I- | ||
| C. | Ba2+K+ S2- Cl- | D. | Zn2+ Na+ NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,氧元素氧化了硫元素 | |
| B. | 该反应从电子转移角度看,每生成6 molCu,转移电子12 mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应从电子转移角度看,与SO2+2H2S=3S↓+2H2 O是同一反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池通过阳离子的移动,保持溶液中电荷平衡 | |
| B. | 电池工作时,电流表指示出从Zn极到Cu极的电流方向 | |
| C. | 电池工作过程中,乙池的c(SO42-)逐渐减小 | |
| D. | 电池工作一段时间后,甲池中溶液质量明显增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下,与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯银制品在空气中久置变黑,是因为发生了电化学腐蚀 | |
| B. | 氨常用作制冷剂,是因为其沸点极低,易液化 | |
| C. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化 | |
| D. | 明矾具有强氧化性,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ③④⑤⑥ | B. | ①③④⑤ | C. | ①②③⑥⑦ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com