
| 实验事实 | 结论 | |
| A | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| B | Cl2的水溶液可以导电 | Cl2是电解质 |
| C | 将CO2气体通入苯酚钠溶液出现浑浊 | 酸性:H2CO3>苯酚 |
| D | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.一般来说,在同一个反应中,还原剂的还原性大于还原产物的还原性;
B.电解质为化合物;
C.反应符合强酸制备弱酸的特点;
D.使湿润红色石蕊试纸变蓝的气体为氨气.
解答 解:A.将燃烧的镁条放入CO2中能继续燃烧,反应生成MgO和C,Mg为还原剂,由还原剂的还原性大于还原产物的还原性可知,还原性:Mg>C,故A正确;
B.Cl2的水溶液可以导电,是因氯气与水反应生成的酸电离产生自由移动的离子,而氯气为单质,既不是电解质也不是非电解质,故B错误;
C.将CO2气体通入苯酚钠溶液出现浑浊,说明生成苯酚,可说明酸性:H2CO3>苯酚,故C正确;
D.产生的气体能使湿润红色石蕊试纸变蓝,气体为氨气,则某无色溶液中加入氢氧化钠溶液并加热生成氨气,原溶液中存在NH4+,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、电解质判断、非金属性比较及离子检验等,把握物质的性质及现象与反应的关系为解答的关键,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
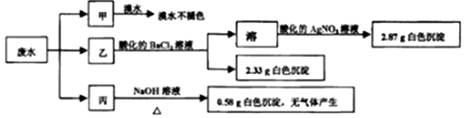
| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
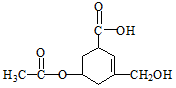
| A. | R的所有原子一定在同一平面上 | |
| B. | 在Ni催化和加热条件下,lmolR能与3molH2发生加成反应 | |
| C. | R既能与羧酸、醇反应,还能发生水解、加成和氧化反应 | |
| D. | 1molR与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置和试剂 | 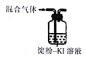 | 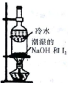 | 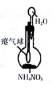 |  |
| 实验目的 | 检验NO2中混有溴蒸汽 | 分离潮湿的NaOH和I2 | 验证NH4NO3溶解吸热 | 制备和收集SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花、羊毛、丝绸的主要成分均为蛋白质 | |
| B. | 丙烷中的3个碳原子一定在同一平面上 | |
| C. | 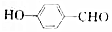 中含有的官能团有3种 中含有的官能团有3种 | |
| D. | 乙烯使溴水和酸性KMnO4溶液褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
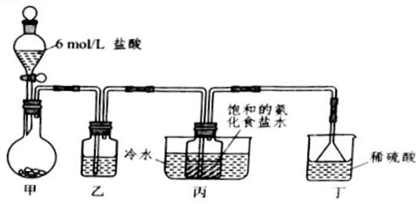
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com