
| A. | 互为同位素 | B. | 互为同系物 | C. | 互为同分异构体 | D. | 互为同种物质 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合物:漂白粉、福尔马林、水玻璃 | B. | 化合物:CaCl2、烧碱、HD | ||
| C. | 电解质:明矾、HCl、硫酸钡 | D. | 纯净物:干冰、冰水混合物、红宝石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| D. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Z>Y>X | B. | 单质密度:Y>X>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化一一共价键 | B. | 二氧化硅熔融--范德华力 | ||
| C. | 氢氧化钠溶于水--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
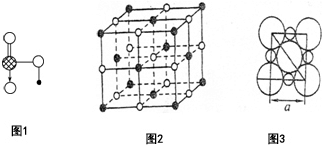 (1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.
(1)Na、Cu、Si、H、C、N六种元素,其对应单质的熔点按照A、B、C、D、E、F的顺序依次升高,其中C、D均是热和电的良导体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com