
下列说法错误的是
A.硝酸能溶解除金、铂外的大多数金属
B.汽车尾气中含有NO和CO
C.浓氨水可检验氯气管道漏气
D.制取二氧化氮时,常用水吸收尾气
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
② NH3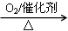 NO
NO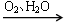 HNO3
HNO3
③NaCl(饱和)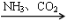 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3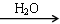 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
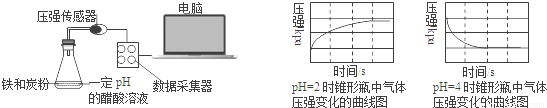
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式正确且能解释事实的是
A.SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32-
B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:
Ca2++HCO3-+OH-═CaCO3↓+H2O
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:
4H++4I-+O2═2I2+2H2O
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ = 2Cr3+ + Fe3+ + 7H2O
查看答案和解析>>
科目:高中化学 来源:2016届河南省英文学校高三上学期期中测试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述中正确的是
A.在18 g 18O2中含有NA个氧原子
B.1 mol FeI2与足量氯气反应对转移的电子数为2
C.1 mol Cl2参加反应转移电子数一定为2 NA
D.标准状况下,2.24L四氯化碳含有分子数目为0.1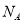
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:实验题
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:

(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式 。
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,适宜的条件还可以选择 (任写一种)。
(3)过滤时所需玻璃仪器为漏斗、玻璃棒和烧杯。从滤液中得到X为绿矾(FeSO4·7H2O)晶体的实验操作依次为:加热浓缩、冷却结晶、过滤洗涤、低温干燥。实验室要配制、保存该溶液时需加少量铁屑,目的是 。
(4)第③步反应化学方程式 。
(5)若实验时需要450mL2mol/L的C溶液,则在精确配制时,需用托盘天平称取NaOH固体 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙外,还必须有 (填仪器名称)。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
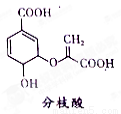
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列有关物质制备说法不正确的是
A.电解饱和食盐水制得金属Na
B.电解熔融MgCl2制得金属Mg
C.高温下CO还原赤铁矿可用于炼铁
D.高温下焦炭还原二氧化硅制得粗硅
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中测试化学试卷(解析版) 题型:计算题
(10分)某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
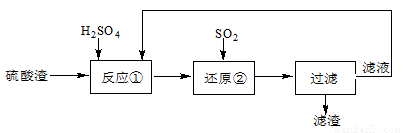
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右所示。得出结论:该反应的温度不宜过高。

①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:
2Fe3++2I-=2Fe2++I2;2Na2S2O3 + I2 = Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com