
| A. | ①② | B. | ①②④ | C. | ①②③ | D. | 全部 |
分析 依据①②③④得,可能含的碳酸盐有NaHCO3、BaCO3、CaCO3、Cu2(OH)2CO3,采用极限的思想,故假设都是NaHCO3,即NaHCO3+HCl=NaCl+CO2↑+H2O,据此求得NaHCO3的质量,以此为思想求得其它固体的质量,最后如果固体的质量能配成24g即可.
解答 解:依据①②③④得,可能含的碳酸盐有NaHCO3、BaCO3、CaCO3、Cu2(OH)2CO3,采用极限的思想,故
假设都是NaHCO3,即NaHCO3+HCl=NaCl+CO2↑+H2O,
84 22.4
16.8 4.48,故m(NaHCO3)=16.8g,
假设都是BaCO3,即BaCO3+2HCl=BaCl2+CO2↑+H2O,
197 22.4
39.4 4.48,故m(BaCO3)=39.4g,
假设都是CaCO3,即CaCO3+2HCl=CaCl2+CO2↑+H2O,
100 22.4
20 4.48,故m(CaCO3)=20g,
假设都是Cu2(OH)2CO3,即Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,
222 22.4
44.4 4.48,故m(Cu2(OH)2CO3)=44.4g,
①可能为NaHCO3、BaCO3的混合物,则固体的质量介于16.8g~39.4g,可能配成24g,故①正确;
②可能为CaCO3、Cu2(OH)2CO3的混合物,则固体的质量介于20g~44.4g,可能配成24g,故②正确;
③可能为BaCO3、Cu2(OH)2CO3的混合物,则固体的质量介于39.4g~44.4g,不可能配成24g,故③错误;
④可能为NaHCO3、CaCO3的混合物,则固体的质量介于16.8g~20g,不可能配成24g,故④错误;
故①②正确,故选A.
点评 本题题目注意极限思想的应用,正确书写方程式也是本题解题的关键,本题题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管和容量瓶在使用前都要用相应溶液润洗 | |
| B. | 常温下,向Fe和Cu中分别加人浓硝酸,可以比较Fe和Cu的金属活动性强弱 | |
| C. | 制取无水MgCl2固体,可将MgCl2溶液置于蒸发皿中加热蒸干 | |
| D. | 分离乙酸乙酯和饱和Na2CO3溶液可用分液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cr的价电子排布式为3d44s2 | |
| B. | 电子式为  可以同时表示羟基和氢氧根离子 可以同时表示羟基和氢氧根离子 | |
| C. | 1s22s22p3和 1s22s22p4能形成AB2型共价化合物 | |
| D. | 基态镁原子核外电子排布图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
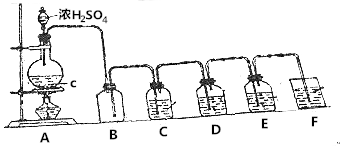 根据如图回答:
根据如图回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 天然气在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D | 乙酸具有酸性 | 常用于去除水垢 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
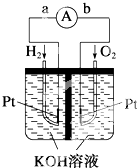 氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com