
����Ŀ���ⶨ0.1mol��L-1Na2SO3��Һ�������ٽ��¹����е�pH���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��BaCl2��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ���ǣ� ��
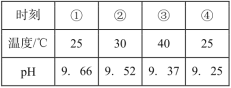
A.Na2SO3��Һ�д���ˮ��ƽ�⣺SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
B.�ܲ����İ�ɫ������BaSO4
C.�����۵Ĺ����У�c(SO32-)�ڽ���
D.�����۵Ĺ����У��¶���c(SO32-)��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
���𰸡�D
��������
A. Na2SO3����ǿ�������Σ�SO32-����ˮ��ƽ�⣺SO32-+H2O![]() HSO3-+OH-��HSO3-+H2O
HSO3-+OH-��HSO3-+H2O![]() H2SO3+OH-����A��ȷ��
H2SO3+OH-����A��ȷ��
B. ��ʵ������У�ȡ�٢�ʱ�̵���Һ�����������ữ��BaCl2��Һ���Ա�ʵ�飬���ް�ɫ������˵������Һ���������ƺ����ᷴӦ���ٲ����Ȼ�����Һ��Ӧ���ܲ�����ɫ������˵�����ȹ������в����������Ʊ��������������ƣ������ƺ��Ȼ�����Ӧ����BaSO4��ɫ��������B��ȷ��
C. �����۵Ĺ��̣������¶�SO32-ˮ��ƽ�������ƶ���c(SO32-)��С����C��ȷ��
D. �ٵ��۹����¶����ߣ���ҺpH���ͣ�˵���¶����߲�û���ٽ�ˮ��ƽ�����Ƶ����ã�����Ũ����������ˮ�������ƶ���������������������������Ϊ�������������Ũ�ȼ�С��ƽ�������ƶ�����˶�ˮ��ƽ���ƶ������Ӱ��̶ȸ�����Ǻ���c(SO32-)����D����
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
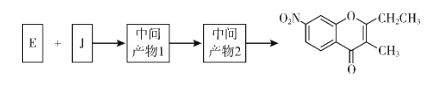
����Ŀ��ɫͪ�����K���п�������Ѫ֬���������ԣ���ϳ�·�����£�
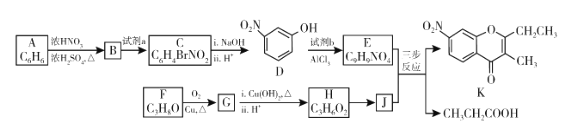
��֪��
��
��
![]()
��
��![]() ����������
����������
��1��A�Ľṹ��ʽ��_________������ϵͳ��������F��������__________��
��2��B��C�����Լ�a��__________���Լ�b�Ľṹ��ʽ��_________��
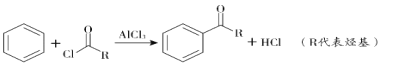
��3��C��������![]() ��Ӧ�Ļ�ѧ����ʽΪ__________��
��Ӧ�Ļ�ѧ����ʽΪ__________��
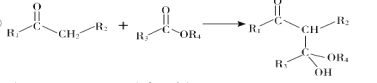
��4��G������![]() ��Ӧ�Ļ�ѧ����ʽΪ__________��
��Ӧ�Ļ�ѧ����ʽΪ__________��
��5����֪����![]() ����J�����������ֻ�ѧ������ͬ������E��JΪԭ�Ϻϳ�K��Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��__________
����J�����������ֻ�ѧ������ͬ������E��JΪԭ�Ϻϳ�K��Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2020��5��1�ձ�������ȫ�з�Χ�ڿ�չʩ���������࣬�������������ȷ�ǣ� ��
A.��ǡ���Ҷ | B.�����������װ�� | C.����������� | D.���鲣�� |
|
|
|
|
�������� | �к����� | �ɻ������� | �������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������������Ӧʵ��������ǣ� ��
A.������þ����Һ�еμ��Ȼ����Һ�������ܽ⣺Mg(OH)2+2NH![]() =Mg2++2NH3��H2O
=Mg2++2NH3��H2O
B.��ˮ�еμӱ����Ȼ�����Һ�õ����ɫҺ�壺Fe3++3H2O=Fe(OH)3��+3H+
C.��ʳ������ϴˮ����CO![]() +2CH3COOH=2CH3COO-+H2O+CO2��
+2CH3COOH=2CH3COO-+H2O+CO2��
D.84����Һ��������ò����ж����壺ClO-+Cl-+2H+=Cl2��+OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������N2(g)��H2(g)����NH3(g)��N2(g)+3H2(g)![]() 2NH3(g) ��H=��92.4 kJmol��1��
2NH3(g) ��H=��92.4 kJmol��1��
��1����һ���¶��£�����10amol N2��30amol H2����2 L���ܱ������У���ַ�Ӧ����ƽ��ʱN2��ת����Ϊ60%����÷�Ӧ��ƽ�ⳣ��Ϊ________���ú�a�Ĵ���ʽ��ʾ��������ʱ�����������Ͷ��10amol N2��20amol H2��20amol NH3���ж�ƽ���ƶ��ķ�����______�����������ƶ����������ƶ����������ƶ�������
��2������Ӧ��ʼʱN2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.1 mol��L��1����NH3�ﵽƽ��ʱŨ�ȵķ�ΧΪ_____����ƽ��ʱN2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.1 mol��L��1����NH3��ʼʱŨ�ȵķ�ΧΪ_____��
��3��һ�������£����ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
�ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� ��Ӧ��Ͷ���� | �� | �� | �� | |
1molN2��3molH2 | 2molNH3 | 4molNH3 | ||
ƽ��ʱ���� | ��Ӧ�����仯�ľ���ֵ(kJ) | Q1 | Q1 | Q1 |
��Ӧ��ת���� | a1 | a2 | a3 | |
��ϵѹǿ(Pa) | p1 | p2 | p3 | |
��Q1+Q2=___kJ��a1+a2___l��������������������=������ͬ����2p2___p3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����ʵ��I��֤Fe2(SO4)3��Cu�ķ�Ӧ���۲쵽���쳣�����������������̽����
ʵ��I��
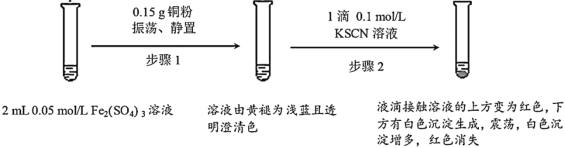
��1��Fe2(SO4)3��Һ�����³����Ե�ԭ����___��
��2��Fe2(SO4)3��KSCN��Һ��Ӧ�����ӷ���ʽΪ___��
��3��ʵ��ǰ��С��ͬѧԤ�⾭������2����Һ��Ӧ�ó��ֺ�ɫ��������__��
��4��ʵ��С���ɫ�����IJ�������������̽��
�������ϣ�i.CuSCNΪ������ˮ�İ�ɫ���塣
ii.SCN-����Ϊ��±�����ӣ�������±����������
����ʵ��ⶨ��ɫ����ΪCuSCN���������Ϻ�С��ͬѧ�²�CuSCN���������������ֿ���
�²�1��Cu2+��KSCN������������ԭ��Ӧ
�²�2���������ӽ��仹ԭCu2++Fe2+=Cu++Fe3+��Cu++SCN-=CuSCN��
Ϊ֤ʵ����С��ͬѧ����ʵ��II��III����FeSO4��CuSO4��ҺŨ��Ϊ0.1mol/L��KSCN��ҺŨ��Ϊ0.4mol/L��
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
II |
| ����1mLKSCN��Һ | ��ʼʱ��Һ���Ϸ���Ϊ��ɫ��һ��ʱ����ɫ�������ӣ���������֧�Թ� |
| ����1mLKSCN��Һ | ��Һ�����ɫ |
�ٲ²�1�����ӷ���ʽ____��
��ʵ��II���Թ�__������ĸ���е��������֤ʵ�²�1��������
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�ʺ�ɫ | ||
| ����4mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ��dz��ɫ | ||
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�����ɫ |
��5��Fe3+�������Ա�Ӧǿ��Cu2+�����ʵ��III�е��������Cu2++Fe2+=Cu++Fe3+����������ԭ����___��
��6��ʵ��С��������ϲ����ۺ�ó�����Һ�������ڷ�Ӧʱ�����ֵ�������ǿ������Ӧ��ԭ����ļ�̬��״̬�йء��ɴ˷�������CuSCN����ʹCu2+����������ǿ��������ʵ���һ��֤���������ʵ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
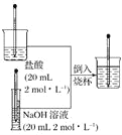
����Ŀ��������ͼ��ʾ�IJ������裬�����������������ķ�Ӧ��ʵ�顣
�ش��������⣺
(1)��Ӧ������Һ���¶��뷴Ӧǰ���������������Һ���¶���Ƚ���仯��___________________________________��
(2)����Ϊ����кͷ�Ӧ�Ƿ��ȷ�Ӧ�������ȷ�Ӧ____________________________________��
(3)д���÷�Ӧ�����ӷ���ʽ��____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��2012���ذ��˻�����ñ���Ϊȼ�ϡ�������ֵ�ϸߣ���Ⱦ��С����һ��������ȼ�ϡ��Իش��������⣺

����ͼ��һ����������ȫȼ������CO2��1 mol H2O(l)�����е������仯ͼ������ͼ�е����������롰����������
��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________________��
��������(CH3OCH3)��һ������ȼ�ϣ�Ӧ��ǰ��������1 mol��������ȫȼ������CO2��Һ̬ˮ�ų�1 455 kJ��������1 mol����Ͷ����ѵĻ��������ȫȼ������CO2��Һ̬ˮ���ų�1 645 kJ���������������У�����Ͷ����ѵ����ʵ���֮��Ϊ________��
��2����˹������Ϊ�����ܻ�ѧ������һ����ɻ�ּ�����ɣ��������̵�����ЧӦ��ͬ�������ø�˹���ɻش��������⣺
����֪��H2O(g)=H2O(l)����H1����Q1 kJ/mol C2H5OH(g)=C2H5OH(l)����H����Q2 kJ/mol
C2H5OH(g)��3O2(g)=2CO2(g)��3H2O(g)����H3����Q3 kJ/mol
��ʹ46 gҺ̬��ˮ�ƾ���ȫȼ�գ����ָ������£������������зų�������Ϊ________kJ��
��̼(s)��������Ӧ������ʱ������COͬʱ����������CO2�������ͨ��ʵ��ֱ�Ӳ�÷�Ӧ�� C(s)��![]() O2(g)=CO(g)�Ħ�H���������ʵ�顢���ø�˹���ɼ�����÷�Ӧ�Ħ�H������ʱ��Ҫ��õ�ʵ��������________��
O2(g)=CO(g)�Ħ�H���������ʵ�顢���ø�˹���ɼ�����÷�Ӧ�Ħ�H������ʱ��Ҫ��õ�ʵ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NA�ǰ����ӵ�������ֵ�����й���ͭ���ⷴӦ2Cu+O2+H2O+CO2=Cu2(OH)2CO3��˵���������
A.����32gCuת�Ƶĵ�����ΪNAB.1.8g H2O���е�������ΪNA
C.22g CO2�Ĺ��õ��Ӷ���ΪNAD.�������11.2LO2��CO2���������Oԭ����ΪNA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com