
【题目】含A元素的一种单质是一种重要的半导体材料,含 A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)A的原子结构示意图为________,A与碳在原子的电子层结构上的相同点是________________________________________________________。
(2)易与C发生化学反应的酸是_________(写名称),反应的化学方程式是_______________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D
①写出该反应的化学方程式:___________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
【答案】 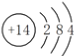 最外层均有4个电子,最内层均有2个电子 氢氟酸 SiO2+4HF===SiF4↑+2H2O SiO2+Na2CO3
最外层均有4个电子,最内层均有2个电子 氢氟酸 SiO2+4HF===SiF4↑+2H2O SiO2+Na2CO3 ![]() Na2SiO3+CO2↑ C 50%
Na2SiO3+CO2↑ C 50%
【解析】试题分析:本题考查无机推断、侧重硅元素的单质及其化合物性质的考查、化学计算。含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造光导纤维,则A为硅元素,C为SiO2;C(SiO2)与烧碱反应生成Na2SiO3和H2O,含A元素的化合物D为Na2SiO3。
(1)A为Si,Si原子的核电荷数为14,Si原子核外有14个电子,根据原子核外电子排布规律,A的原子结构示意图为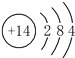 。碳的原子结构示意图为
。碳的原子结构示意图为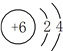 ,硅原子与碳原子的电子层结构上的相同点是:最外层均有4个电子,最内层均有2个电子。
,硅原子与碳原子的电子层结构上的相同点是:最外层均有4个电子,最内层均有2个电子。
(2)C为SiO2,易与SiO2发生化学反应的酸是氢氟酸,SiO2与HF反应生成SiF4和H2O,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(3)①SiO2与纯碱高温熔融时反应生成Na2SiO3和CO2,反应的化学方程式为SiO2+Na2CO3![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。
②A,普通玻璃的成分为Na2SiO3、CaSiO3和SiO2,SiO2与纯碱高温下反应生成Na2SiO3和CO2,不能选用普通玻璃坩埚熔化纯碱;B,石英玻璃的成分为SiO2,SiO2与纯碱高温下反应生成Na2SiO3和CO2,不能选用石英玻璃坩埚熔化纯碱;C,铁与Na2CO3高温不反应,可选用铁坩埚熔化纯碱;答案选C。
(4)SiO2与石灰石的混合物充分反应,可能发生的反应有SiO2+CaCO3![]() CaSiO3+CO2↑、CaCO3
CaSiO3+CO2↑、CaCO3![]() CaO+CO2↑,根据C守恒,n(CaCO3)=n(CO2)=
CaO+CO2↑,根据C守恒,n(CaCO3)=n(CO2)=![]() =0.5mol,m(CaCO3)=0.5mol
=0.5mol,m(CaCO3)=0.5mol![]() 100g/mol=50g,100g混合物中石灰石的质量分数为
100g/mol=50g,100g混合物中石灰石的质量分数为![]() 100%=50%。
100%=50%。


科目:高中化学 来源: 题型:
【题目】某有机化合物A的相对分子质量范围为100~130.经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
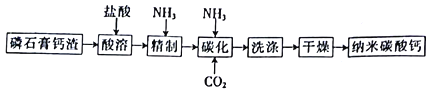
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有___________(填字母)。
A.粉碎磷石膏钙渣 B.增大盐酸浓度 C.适当降低温度 D.缩短酸溶时间
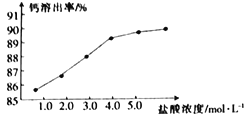
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为___________。
(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去___________(填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式___________(填化学式);碳化时发生反应的化学方程式为___________________________________________。
(5)把CaCO3浊液滴入1.0mol·L-1 的Na2SO3溶液中,能否产生CaSO3沉淀?___________。若不能,说明原因;若能,请从定量的角度简述判断依据:___________________________________。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( ) 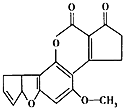
A.6mol,2mol
B.7mol,2mol
C.6mol,1mol
D.7mol,1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器经常用于物质分离的有( )
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶 ⑦蒸发皿 ⑧坩埚
A. ①③⑤⑥ B. ①②④⑥ C. ①③⑤⑦ D. ①③⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市内机动车尾气污染越来越严重,已知三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其基本反应原理为C3N3(OH)3![]() 3HNCO,8HNCO+6NO2
3HNCO,8HNCO+6NO2![]() 7N2+8CO2+4H2O。下列说法正确的是
7N2+8CO2+4H2O。下列说法正确的是
A. C3N3(OH)3与HNCO为同一物质
B. 1 mol NO2在反应中转移的电子为4 mol
C. HNCO是一种很强的氧化剂
D. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
A.失去电子,化合价降低的物质是还原剂B.被氧化的物质是还原剂
C.氧化剂被氧化,还原剂被还原D.氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 2.0gH218O与2.0gD2O中所含的中子数均为NA
B. 14g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C. 100g质量分数为17%的H2O2水溶液中氢原子数为NA
D. 常温下,将56g铁片投入到足量的浓硫酸中生成SO2的分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置,其中正确的是
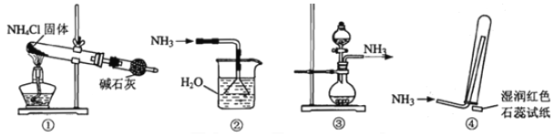
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com