
下列关于试剂存放的叙述正确的是
A.硝酸银溶液存放在无色试剂瓶中
B.金属钠保存在CCl4中(钠的密度小于CCl4)
C.浓硫酸的装运包装箱应贴上如图所示的标识
D.氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
将金属铜、铁置于氯化铁溶液中充分反应,下列对反应情况设想的评价正确的是 ( )
选项 | 反应情况设想 | 评价 |
A | 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ | 正确,Fe3+和Fe、Cu均可反应 |
B | 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+、无Fe3+ | 正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+ |
C | 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ | 正确,Cu有剩余,故无Cu2+ |
D | 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ | 不正确,不可能有Fe剩余而无Cu剩余,因为Fe比Cu优先与Fe3+反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
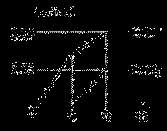
A.反应中转移电子的物质的量是0.21 mol
B.ClO3-的生成是由于温度升高引起的
C.苛性钾溶液中KOH的质量为5.04g
D.反应中氧化剂和还原剂的物质的量之比为7:3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式 。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有 。
(3)滤渣A的主要成分为 ;滤渣A的用途是 (写一种)。
(4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ ________ 。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是
A.都不正确 B.①②⑤ C.②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法或有关化学用语表达正确的是
A.二氧化碳的结构式:O—C—O
B.Cl-的结构示意图:
C.乙醇的结构简式:CH3CH2OH
D.过氧化氢(D2O2)的相对分子质量为34
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:填空题
(12分)(1)选择填空:将铝的用途与性质搭配起来(每个选项只选用一次)。
A.质轻
B.延展性好
C.易传热
D.易导电
E.氧化时放热
①太阳能热水器:__________;②飞机:__________;③焊接铁轨:____________;④电缆:__________;⑤铝箔:__________。
(2)佛山是有色金属之乡,其中铝合金材料的产量约占全国的一半。铝合金材料属于__________(填“纯净物”、“混合物”或“单质”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(选做题16分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-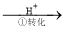 Cr2O72-
Cr2O72-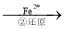 Cr3+
Cr3+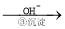 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+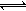 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2v (Cr2O72-)= v (CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4 7H2O。
7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在沉淀溶解平衡,请写出其沉淀溶解平衡方程式
常温下,Cr(OH)3的溶度积Ksp=[Cr3+]·[OH?]3=10?32,要使c(Cr3+)降至10?5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因是 。
⑹在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中一定能共存的是
A.Na+、Fe2+、Clˉ、SO42ˉ B.Na+、K+、SO42ˉ、Clˉ
C.K+、Na+、HCO3ˉ、NO3ˉ D.K+、Clˉ、Al3+、CO32ˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com