
分析 (1)根据n=$\frac{m}{M}$计算出氨气的物质的量,然后结合热化学方程式书写原则,标注物质聚集状态和对应焓变;
(2)根据热化学方程式的书写方法结合热化学方程式的意义来回答.
解答 解:(1)17g氨气的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气完全分解吸收热量为46.1kJ,则该反应的热化学方程式为:2NH3(g)?N2(g)+3H2(g)△H=+92.2kJ/mol,
故答案为:2NH3(g)?N2(g)+3H2(g)△H=+92.2kJ/mol;
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ,所以54g铝与足量氯气化合生成固体氯化铝,放出热量1645.2kJ,则热化学方程式:2Al(s)+3Cl2(g)═2AlCl3(s),△H=-1645.2kJ/mol,
故答案为:2Al(s)+3Cl2(g)═2AlCl3(s),△H=-1645.2kJ/mol.
点评 本题主要考查了热化学方程式的书写,题目难度不大,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.


科目:高中化学 来源: 题型:解答题
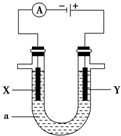 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2 L甲烷含有2NA个共价键 | |
| B. | 4.8 g Mg和氯气反应得到电子数为0.4 NA个 | |
| C. | 0.1 mol•L-1的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
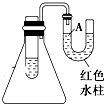 如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1569.84kJ | B. | 78.584kJ | C. | 6548.6kJ | D. | 4978.88kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过量的NaOH与Ca(HCO3)2反应:2OH-+Ca2++2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对因胃酸过多而导致胃部严重溃疡的病人不可使用含有碳酸氢钠的药物治疗 | |
| B. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| C. | 误食了重金属离子,应立即喝大量牛奶来缓解毒性 | |
| D. | R表示非处方药,OTC表示处方药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com