
 ;
; ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.分析 A、B、C、D、E、M六种元素均位于周期表的前四周期,它们的原子序数依次增大,M的原子序数为29,则M为Cu;其余的均为短周期主族元素,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X,则B为N元素、X为NH4NO3;D与A同主族,D的原子序数大于氮元素,故D为Na;E处于第三周期,E元素的最外层电子数是其次外层电子数的$\frac{3}{4}$倍,最外层电子数为6,故E为S元素;由原子序数可知,C为O、F中的一种,而A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素,据此解答.
解答 解:A、B、C、D、E、M六种元素均位于周期表的前四周期,它们的原子序数依次增大,M的原子序数为29,则M为Cu;其余的均为短周期主族元素,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物反应生成一种盐X,则B为N元素、X为NH4NO3;D与A同主族,D的原子序数大于氮元素,故D为Na;E处于第三周期,E元素的最外层电子数是其次外层电子数的$\frac{3}{4}$倍,最外层电子数为6,故E为S元素;由原子序数可知,C为O、F中的一种,而A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素.
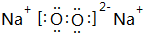
(1)Cu+的核外电子排布式为1s22s22p63s23p63d10,D与C形成原子个数比为1:1的化合物为Na2O2,电子式是 ,
,
故答案为:1s22s22p63s23p63d10; ;
;
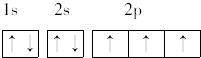
(2)B为N元素,原子的电子排布图是 ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形,
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形,
故答案为 ;7;2p;哑铃;
;7;2p;哑铃;
(3)S元素的最高价态与H、N、O形成酸式盐Y的化学式是NH4HSO4,溶液中完全电离得到H+、SO42-、NH4+,溶液呈酸性,而NH4+水解,溶液中H+浓度大于SO42-的,NH4+浓度小于SO42-的,故水溶液中的离子浓度由大到小的顺序是:c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:NH4HSO4;c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(4)常温时,B元素的最高价氧化物对应水化物Z为HNO3,pH=a的硝酸溶液中水电离的氢离子等于溶液中氢氧根离子,故c(H+)1=10-14+amol/L,盐NH4NO3的溶液的pH=a,铵根离子水解溶液呈酸性,溶液中氢离子源于水的电离,则c(H+)2=10-amol/L,则c(H+)1:c(H+)2=10-14+amol/L:10-amol/L=102a-14,
故答案为:102a-14.
点评 本题比较综合,涉及元素推断、核外电子排布、核外电子运动、电子式、离子浓度大小比较、盐类水解等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量不是国际单位制的七个基本物理量之一 | |
| C. | 物质的量是摩尔的单位 | |
| D. | 阿伏加德罗常数的数值约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | ||||||||
| 2 | ||||||||
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com