
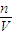 分析操作对溶液浓度影响.
分析操作对溶液浓度影响. 理解溶液配制,把握整个配制过程,注意氢氧化钠应放在烧杯内称量.
理解溶液配制,把握整个配制过程,注意氢氧化钠应放在烧杯内称量. 

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013年福建省清流一中高一上学期第二阶段考试化学试卷(带解析) 题型:实验题
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取 g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中 ;
C.容量瓶内壁沾有水滴没有烘干就进行配制 ;
D.定容时俯视 ;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试理综化学试卷(解析版) 题型:填空题
回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;
⑦燃烧匙。常用于物质分离的是________________,其中根据物质沸点不同来分离物质的仪器是____________。(用序号填写)
(2)今欲用NaOH固体配制220mL 0.2mol/L的NaOH溶液。根据题意填空:
A.配制该溶液应选用玻璃仪器_________ mL容量瓶。
B.用托盘天平称取 ________ g NaOH固体。
C.将称好的NaOH固体放至烧杯中,倒入约25mL蒸馏水,用__________搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻摇动容量瓶,使溶液混和均匀。
E.向容量瓶中加入蒸馏水,直到液面离刻度线下1-2厘米时,改用___________ 滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果溶液未冷却就进行定容,将使配得的溶液浓度___________(填“偏高”、“偏低”或 “无影响”)。
F.配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期第二阶段考试化学试卷(解析版) 题型:实验题
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取 g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中 ;
C.容量瓶内壁沾有水滴没有烘干就进行配制 ;
D.定容时俯视 ;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com