
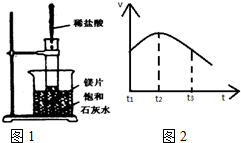
 氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.
氢气是新能源家族的重要成员,请解决下列与氢气相关的问题.分析 (1)根据氢气具有可燃性,燃烧时的发热量高,燃烧的产物是水无污染,可以用水制取氢气,来源广,据此分析解答;
(2)①金属镁和酸反应生成盐和氢气;
②金属和酸的反应是放热反应,氢氧化钙的溶解度随着温度升高而降低,随着温度的降低而升高;
(3)①t1─t2阶段:金属与酸的反应为放热反应,温度影响化学反应速率;
②t2─t3阶段:随着反应的进行,酸的浓度降低反应减慢.
解答 解:(1)氢气燃烧时的发热量高,燃烧的产物是水无污染,可以用水制取氢气,来源广,故答案为:燃烧时不污染环境或可循环利用等;
(2)①金属镁和盐酸反应产生大量的热,冒气泡,该热量能使氢氧化钙的溶解度降低,所以饱和石灰水中溶液变浑浊,
故答案为:溶液变浑浊,冒气泡;
②金属镁和盐酸反应产生大量的热,该热量能使氢氧化钙的溶解度降低,所以饱和石灰水中溶液变浑浊,
故答案为:该反应放热,温度升高,Ca(OH)2的溶解度变小而析出;
(3)①金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快,
故答案为:反应放热,溶液温度升高使反应速率加快;
②随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小,
故答案为:随着反应的进行,酸的浓度降低反应减慢.
点评 本题考查了影响反应速率的因素,理解所学知识要点,通过比较、分析是解答的关键,注意外界条件影响化学反应速率,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 非金属之间形成的化学键一定是共价键 | |
| B. | 在共价化合物中不可能含有离子键 | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定很容易发生 | |
| B. | 化学反应一定既伴随着物质变化又伴随着能量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
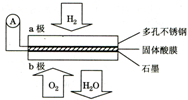
| A. | a极为负极,工作过程中a极附近酸性增强 | |
| B. | 电池总反应可表示为:2H2+O2=2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1mol电子,消耗标准状况下2.24L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与乙烯互为同系物 | |
| B. | 其具有6种同分异构体 | |
| C. | 其一氯代物一共有12种 | |
| D. | 该物质的系统命名的名称为“1-丁烯” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(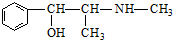 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物溶于水显酸性且稳定性弱于HF | |
| B. | Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | 对应简单离子半径②>⑧>⑨ | |
| B. | 简单氢化物稳定性⑤>⑧ | |
| C. | 最高价氧化物对应的水化物酸性⑨>⑧>⑦ | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com